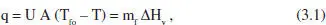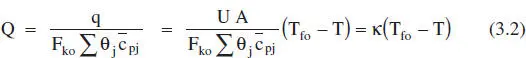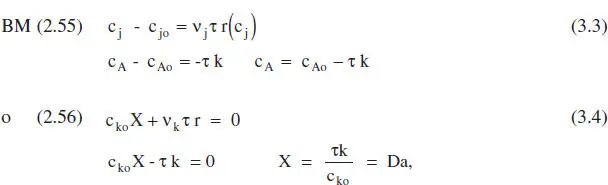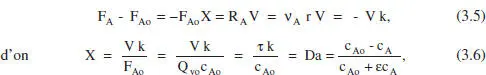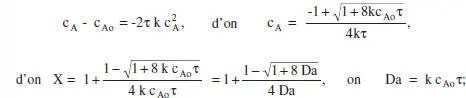Aquest model pot utilitzar-se per a predir el comportament del reactor, és a dir, per a contestar preguntes del tipus: què succeiria si…? Per exemple, què succeiria si fixàrem determinades condicions d’operació?, i si modificàrem algunes d’aquestes condicions? En aquest cas s’hauran de resoldre les equacions del model de manera simultània, ja que les variables implicades en la resposta del sistema (per exemple, X i T ) apareixen en ambdues equacions. En algunes ocasions es poden resoldre les equacions dels balanços de forma separada, la qual cosa sol simplificar el problema. El comportament isoterm és un d’aquests casos simplificats, ja que una de les variables ( T ) deixa de ser-ho. Si aquest paràmetre és conegut, es pot utilitzar el balanç de matèria per a determinar la conversió aconseguida en el reactor, o el volum necessari per a assolir un grau de conversió establit, i el d’energia per a determinar el flux de calor que cal intercanviar.
En el capítol anterior s’ha mostrat alguna aplicació del balanç de matèria al càlcul del volum de reactor (o del temps de reacció) necessaris per a aconseguir una determinada conversió, o viceversa (exemple 2.8). Ací s’insistirà en els aspectes energètics i d’optimació. L’objectiu d’aquest capítol és mostrar l’aplicació dels balanços al disseny dels reactors ideals, així com a l’anàlisi del seu comportament, ambdues operacions en el comportament isoterm. Finalment, ens demanarem per aquelles situacions en les quals aquest comportament és el més interessant.
3.2 RCTA
Aquest reactor, tal com s’ha assenyalat en el capítol anterior (apartat 2.4.2), consisteix en un recipient ben agitat amb un funcionament continu. Una perfecta agitació és fonamental en aquest reactor. El disseny de l’agitador cau fora de l’objectiu d’aquest llibre. Rase (1977) en parla en la seua obra; així mateix, es pot recomanar el treball de Dickey (1991).
Les equacions del model en aquest cas són equacions algebraiques. A continuació es completarà el model, format pel balanç de matèria, amb els aspectes energètics, i es faran algunes aplicacions. El comportament isoterm implica que T = T o.
3.2.1
Sistemes d’intercanvi de calor. Modelització
Els sistemes d’intercanvi per a aquest reactor poden ser: camisa (el reactor té una doble paret, deixant un espai per on circula el fluid bescanviador), serpentí (intern o extern) i bescanviador de calor extern. També pot utilitzar-se calefacció d’origen elèctric mitjançant una resistència submergida o una manta calefactora que li donarà calor a través de la paret. Aquesta opció elèctrica és costosa, motiu pel qual si s’utilitza serà en reactors de grandària reduïda. En la figura 3.1 es mostra un esquema d’alguns d’aquests sistemes:
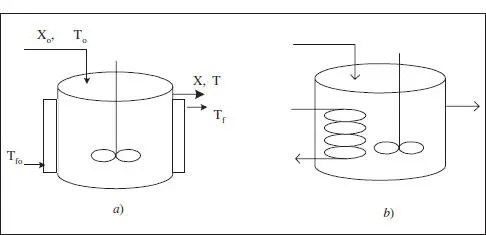
Figura 3.1. Sistemes d’intercanvi en un RCTA. a ) Bescanviador de doble paret. b ) Serpentí intern. T fés la temperatura del fluid bescanviador, el subíndex o fa referència a les condicions d’entrada.
3.2.1.1 Bescanviador de doble paret (camisa)
Si considerem que en aquest cas s’utilitza un fluid bescanviador que canvia de fase, de manera que T fo= T f, podem escriure
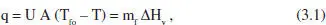
on mf és el cabal de fluid bescanviador que canvia de fase i AHv l’entalpia de canvi de fase. Substituint q en la definició de Q donada en l’equació (2.69):
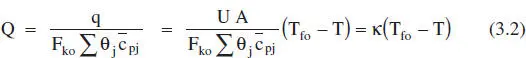
Pot demostrar-se (Aris, 1973; Escardino, 1996) que els altres sistemes d’intercanvi de calor poden representar-se per equacions com la (3.2), encara que les definicions de K(constant que caracteritza l’intercanvi de calor) varien evidentment d’uns casos a altres. De tota manera, es pot afirmar que Kcreix en fer-ho els termes UA i m fc pf, i en decrèixer F koΣθ jc pj.
3.2.2 Relació X-τ(Qvo, V) per a distintes cinètiques
A tall d’exemple es mostrarà Faplicació del model del balanc. de matèria a una cinètica d’ordre zero. Suposem que es tracta d’un sistema de densitat constant. Reacció: A → productes… r = k.
Aplicant el balanc. de matèria a un RCTA, equacions (2.55) i (2.56),
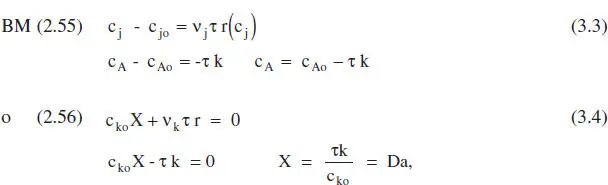
on Da és el mòdul de Damköhler per a una reacció d’ordre zero. Aquestes equacions es mostren gràficament en la figura 3.2.
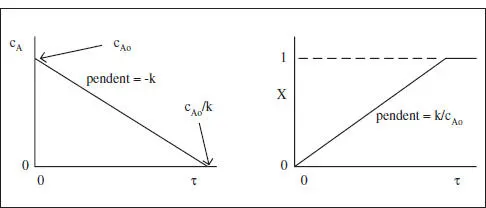
Figura 3.2. Variació de la concentració del reactiu i de la conversió amb el temps espacial, τ , en un RCTA per a una reacció d’ordre zero (ρ constant).
D’altra banda, si es tractara d’un sistema de densitat variable, prenent l’equació (2.39) en estat estacionari com a punt de partida:
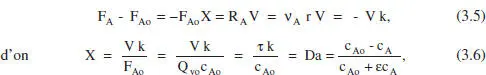
que donarà la relació c A-τ. Veiem que la relació τ-X és la mateixa en tots dos casos, és independent, doncs, per a aquesta cinètica, de si la densitat és constant o no. No és el cas de la relació c A- τ. En el capítol 4 de l’ Omnibook de Levenspiel (1993) es poden consultar les aplicacions d’aquests balangos a altres cinètiques. En la taula 3.1es poden veure algunes de les equacions resultants.
TAULA 3.1 Mòdul de Damköhler (Da) i relació X-Da per als distints reactors ideals i diferents cinètiques de la reacció A → productes

Exemple 3.1
En un RCTA en estat estacionari té Hoc, en fase líquida i de manera isoterma, una reacció elemental de dimerització 2 A → B. Es requereix una equació que permeta obtenir la conversió assolida en el reactor en funció del temps espacial. Compareu aquesta equació amb la mostrada en la taula 3.1, i justifiqueu les diferències.
Solució:
El balan§ de matèria en un RCTA queda C j- C j0= V jτr(C j), i per a la cinètica esmentada:
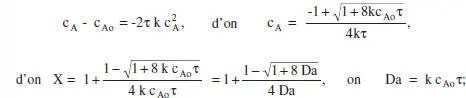
les diferències es deuen a l’estequiometria.
3.2.3 Flux de calor intercanviat
El flux de calor necessari per a mantenir T = T durant el procés es determinarà del balang d’energia, equació (2.68):

Cal insistir que el terme —J X del balanç d’energia no representa la generació d’energia (l’energia és una magnitud conservada). El flux de calor q haurà de ser proporcionat pel sistema d’intercanvi. Adonem-nos que si es tracta d’una reacció endotèrmica (ΔH > 0) , q > 0, lògicament per a desenvolupar-la de forma isoterma s’haurà d’aportar un flux de calor determinat. Si es tracta d’una reacció exotèrmica (ΔH <
0, també lògicament per a tirar endavant de forma isoterma s’haurà d’eliminar un flux de calor determinat. Cal adonar-se també que aquest flux de calor és invariable, la qual cosa és raonable, ja que el reactor treballa en estat estacionari, per això el grau de conversió i la temperatura no canvien amb el temps, la velocitat de reacció tampoc no canviarà, per la qual cosa les necessitats energètiques seran constants.
Читать дальше