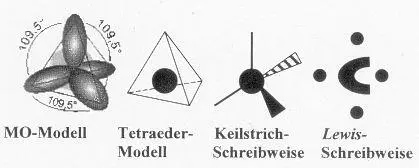
Der Grund dafür liegt darin, dass das C-Atom mit zwei 2s 2 -Elektronen und zwei 2p 1 -Elektronen vier gleichartige sp 3 -Hybridorbitale bildet (vgl. Merksatz 52 zur Hybridisierung ), die räumlich zueinander in Tetraederwinkeln stehen:
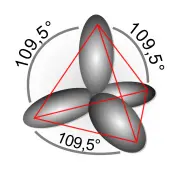 (Bildquelle: Von User:Sven, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=907884)
(Bildquelle: Von User:Sven, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=907884)
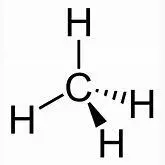
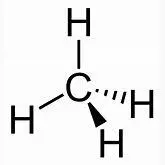
Das C-Atom bildet daher 4 gleiche Bindungen aus:
Hinweis: Jedes der vier H-Atome im Methanmolekül kann durch eine weitere Atomgruppe ersetzt werden, z.B. durch eine, die sich vom Methan ableitet ( CH 3 - oder Methylgruppe ). Wenn ein H-Atom durch eine Methylgruppe –CH 3 ersetzt wird, dann entsteht Ethangas, Summenformel C 2 H 6 : H 3 C-H + H- CH 3 H 3 C-CH 3+ H-H 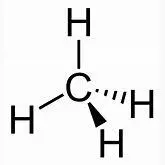 +
+ 
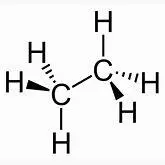 + H-H Die so entstehenden C-C-Bindungen sind stabil. Dadurch entsteht eine große Fülle möglicher KW-Moleküle wie z.B. das Gas Ethan CH 3 -CH 3 (Summenformel: C 2 H 6 ).
+ H-H Die so entstehenden C-C-Bindungen sind stabil. Dadurch entsteht eine große Fülle möglicher KW-Moleküle wie z.B. das Gas Ethan CH 3 -CH 3 (Summenformel: C 2 H 6 ).
1 Eine homologe Reihe ist eine Gruppe von Verbindungen, deren einzelne Mitglieder sich voneinander nur durch die Anzahl ihrer –CH2–Gruppen unterscheiden.
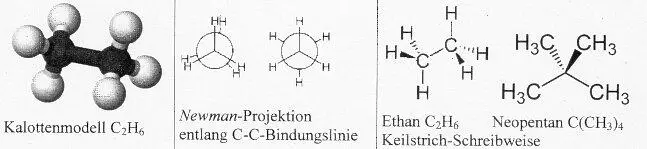
Beispiel: Die Stoffgruppe der Alkane bildet eine homologe Reihe. Die ersten vier Stoffe dieser Reihe sind: Methan CH 4 , Ethan C 2 H 6 , Propan C 3 H 8 , Butan C 4 H 10
 CH 4C 2H 6
CH 4C 2H 6 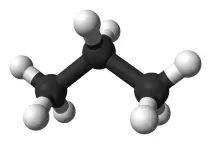 C 3H 8C 4H 10
C 3H 8C 4H 10
Hinweis: Jedes Molekül ist um eine –CH 2 -Gruppe größer. Es ergibt sich eine theoretisch endlose Reihe von Kettenmolekülen. Die allgemeine Summenformel dieser Stoffe ist C n H 2n+2 mit der folgenden Struktur .
Wenn eine der vier C-H-Bindungen im Methanmolekül aufgespalten wird, dann verbleibt ein Methylrest –CH 3 . Zwei Methylreste bilden ein Ethanmolekül CH 3 -CH 3 (Summenformel: C 2 H 6 ). Der Austausch von zwei H-Atomen im Methanmolekül durch Methylgruppen führt zum Propan C 3 H 8 (s.o., als Halbstrukturformel: CH 3 -CH 2 -CH 3 ). Der Austausch aller vier H-Atome führt zum NeopentanC 5 H 12 bzw. C(CH 3 ) 4 :
Ein KW mit einem Kettenmolekül aus 10 C-Atomen heißt Decan C 10 H 22 . KW mit noch längeren Molekülen werden Paraffine genannt. Es handelt sich um wachsartige Stoffe.
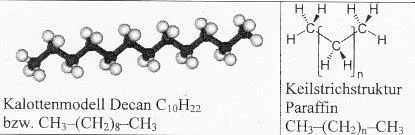
Am Ende dieser Reihe steht der Kunststoff Polyethylen PE . Seine Moleküle mit der Formel C n H 2n+2 sind über 10000 C-Atome lang:Die Formel für ein PE-Molekül z.B. mit n = 10000 wäre dann: C 10000 H 20002 .
1 Eine funktionelle Gruppe(auch: ein Substituent) ist ein Atom oder eine Gruppe von (Hetero-)Atomen in einem Kohlenwasserstoffmolekül, die hierin ein Wasserstoffatom ersetzt.
Beispiel: Wenn Methangas CH 4 mit Chlorgas Cl 2 reagiert, dann entsteht bei der Explosion aus einem Methangasmolekül ein Molekül, in dem ein H-Atom gegen ein Chloratom ausgetauscht wurde. Es entsteht Chlormethan CH 3-Cl . Des Weiteren bleibt Chlorwasserstoffgas HCl zurück:
CH 4+ Cl 2→ CH 3 -Cl+ H -Cl
 + Cl-Cl
+ Cl-Cl 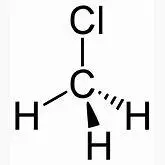 + H-Cl
+ H-Cl
Hinweis: Das Produkt Chlormethan CH 3 Cl enthält die funktionelle Gruppe (den Substituenten) -Cl . Es gehört zu den substituierten Kohlenwasserstoffen – hier: ein Halogenkohlenwasserstoff ( Chlorkohlenwasserstoff , CKW ). Ein Kohlenwasserstoff ohne Substituenten, aber mit weniger als 2n+2 H-Atomen (also ohne die Summenformel C nH 2n+2 wird als „ungesättigt“ oder „aromatisch“ bezeichnet (s.u.).
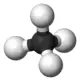
1 Ein gesättigter Kohlenwasserstoff (auch: Alkan) ist eine Verbindung aus Kohlenstoff und Wasserstoff, deren sämtliche Kohlenstoff-Bindungen mit Wasserstoff abgesättigt sind (allgemeine Summenformel: CnH2n+2,ausschließlich C-H- und C-C-Einfachbindungen). Abb.: Der einfachste gesättigte Kohlenwasserstoff ist das Methangas CH4– hier: Gefrorene Methangas-Blasen (Abb. Gemeinfrei)
2 Ein ungesättigter Kohlenwasserstoff ist eine Verbindung aus Kohlenstoff und Wasserstoff, in deren Molekülen sich C=C-Doppel- und/oder CC-Dreifachbindungen befinden.
Beispiel: Das einfachste Molekül eines ungesättigten KW entspricht einem Ethanmolekül, dem zwei H-Atome fehlen. Es handelt sich um Ethen C 2 H 4 (Ethylen, Halbstrukturformel: H 2 C=CH 2 ):
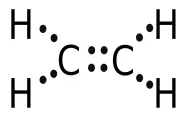 Die Bindungswinkel sind: ,denn die C-Atome sind sp 2 -hybridisiert.
Die Bindungswinkel sind: ,denn die C-Atome sind sp 2 -hybridisiert.
(Bildquelle sp 2-hybridisiertes C-Atom: User Sven, über: https://commons.wikimedia.org/wiki/File:Sp2-Orbital.svg)
Hinweis: Ungesättigte Kohlenwasserstoffe weisen C-C-Mehrfachbindungen auf ( C=C-Doppelbindungen oder sogar C C-Dreifachbindungen ) und sind sehr reaktionsfreudig . Sie können auch mit Wasserstoff zu gesättigten KW (zurück)reagieren („hydriert“ werden). Die zweite C-C-Bindung im Ethenmolekül H 2 C=CH 2 liegt ober- und unterhalb der Molekülebene mit den drei Bindungen im o.g. 120°-Winkel. Sie ist daher leicht angreifbar.
Читать дальше
 (Bildquelle: Von User:Sven, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=907884)
(Bildquelle: Von User:Sven, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=907884)
 +
+ 
 + H-H Die so entstehenden C-C-Bindungen sind stabil. Dadurch entsteht eine große Fülle möglicher KW-Moleküle wie z.B. das Gas Ethan CH 3 -CH 3 (Summenformel: C 2 H 6 ).
+ H-H Die so entstehenden C-C-Bindungen sind stabil. Dadurch entsteht eine große Fülle möglicher KW-Moleküle wie z.B. das Gas Ethan CH 3 -CH 3 (Summenformel: C 2 H 6 ). CH 4C 2H 6
CH 4C 2H 6  C 3H 8C 4H 10
C 3H 8C 4H 10

 + Cl-Cl
+ Cl-Cl  + H-Cl
+ H-Cl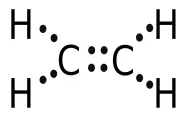 Die Bindungswinkel sind: ,denn die C-Atome sind sp 2 -hybridisiert.
Die Bindungswinkel sind: ,denn die C-Atome sind sp 2 -hybridisiert.










