1 ...7 8 9 11 12 13 ...16 6 Die Gasgesetze beschreiben, wie sich die Zustandsgrößen Druck p, Temperatur T, Volumen V und Stoffmenge n (oder Masse m oder Teilchenzahl N) in einer Gasportion verhalten, wenn man eine dieser Größen verändert.
Beispiel: Einzelne Gasgesetze sind:
a) Nach Avogadro: V ~ n (bei p, T = const.)
p 1 •V 1 = p 2 •V 2 T 1 T 2
b) Nach Boyle-Mariotte: p • V = const. (bei n, T = const. )
c) Nach Gay-Lussac: p ~ T (bei n, V =const. ), V ~ T (bei n, p =const. )
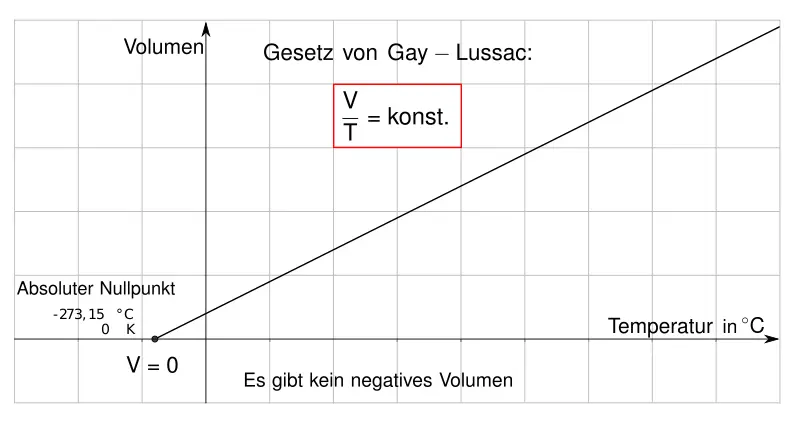
Das Gesetz von Gay-Lussac besagt, dass das Verhältnis von Volumen und Temperatur einer Gasportion bei konstantem Druck immer gleich groß ist. Daraus folgt, dass sich ein Gas bei Abkühlung zusammenzieht – und dass bei etwa -273°C das Volumen auf null schrumpft („Absoluter Nullpunkt“ der thermodynamischen Temperatur, null Kelvin 0 K),. Wie die folgende Abbildung zeigt ( Bildquelle: Johannes Schneideer, wikimedia commons, über: https://commons.wikimedia.org/wiki/File:Ermittlung_des_absoluten_Nullpunktes_mit_dem_Gesetz_von_Gay-Lussac.svg ):
1 Die ideale Gasgleichungp V = n R Tist eine Größengleichung. Sie ermöglicht es, die Stoffmenge einer Gasportion in Abhängigkeit der Zustandsgrößen Druck, Volumen und Temperatur mit Hilfe der allgemeinen Gaskonstante R zu berechnen. (allg. Gaskonstante R = (pV)/(nT) = 8,314 J/molK)
2 Der Gesamtdruck eines Gasgemisches ist die Summe der Teil- / Partialdrücke der einzelnen Gase (Dalton’sches Gesetz).
3 Der Partialdruck eines Gases ist der Druck, der im Volumen des Gasgemisches herrschen würde, wenn dieses Gas sich hierin allein befände. Er ist zugleich ein Maß für dessen Stoffmengenanteil im Gemisch.
Hinweis: Er kann deshalb in die Gleichungen nach dem Massenwirkungsgesetz MWG einbezogen werden. In Lösungen und anderen Stoffgemischen können Anteile und Konzentrationen dabei in folgenden Größen angegeben werden:
Massenanteil w (X) = m (X) : m (Lsg) in: g / kg -1Volumenanteil (X) = V (X) : V (Lm) + V (X) in: mL L -1Stoffmengenanteil (X) = n (X) : n (Lm) + n (X) in: mmol mol -1Massenkonzentration (X) = m (X): V (Lsg) in: kg L -1Volumenkonzentration (X) = V (X) : V (Lsg) in: L L -1Stoffmengenkonzentration c (X) = n (X) : V (Lsg) in: mol L -1Massenverhältnis (X) = m (X) : m (Lm) in: g kg(Lm) -1Volumenverhältnis (X) = V (X) : V (Lm) in: mL L(Lm) -1Stoffmengenverhältnis r (X) = n (X) : n (Lm) in: mmol mol(Lm) -1.
1 Ein Mol eines idealen Gases nimmt ein Molares Volumen von Vm,n = 22,4 L/mol ein (bei Normalbedingungen p0=1013 hPa, T0 = 273 K), es gilt das Allgemeine Gasgesetz (Merksatz 116): p • V = n • R • T mit R = 8,314 (hPa•L)/(mol•K).
Hinweis: Reale Gase folgen stattdessen der van-der-Waals Gleichung und weisen einen Kompressibilitätsfaktor ungleich Eins auf: (p • V) / (R • T) ≠ 1 (bei n=1 mol), denn es herrschen intermolekulare Anziehungskräfte und Molekülvolumina. Reale Gase weisen daher zwei Kritische Daten auf. Die Kritische Temperatur T krit. Ist die Temperatur, oberhalb der eine Gasverflüssigung durch Druckerhöhung unmöglich ist, und der Kritische Druckp krit. ist der Mindestdruck, der zur Gasverflüssigung bei T krit. erforderlich ist.
1 Thermodynamik ist die Lehre der energetischen Erscheinungen bei chemischen Reaktionen. (Hierzu gehören Wärme, elektrische Arbeit und Volumenarbeit bei Stoffumwandlungen in offenen, geschlossenen und isolierten Systemen, d.h. mit und ohne Energie- bzw. Stoffaustausch mit der Umgebung).
2 Die Aktivierungsenergie ist die Energiemenge, die einem Stoffgemisch zugefügt werden muss, damit dessen Reaktion in Gang kommt.
3 Eine exotherme Reaktion setzt aus einem Reaktionsgemisch Wärmeenergie frei (Umwandlung chemischer Energie in Reaktionswärme):Bei einer endothermen Reaktion wird Wärmeenergie vom Reaktionsgemisch aufgenommen (Umwandlung von Wärmeenergie in chemische Energie).
4 Eine Gleichgewichtsreaktion ist eine Stoffumwandlung, die gleichzeitig in zwei Richtungen verlaufen kann: A + B AB (auch: AB + CD AC + BD u.ähn.)Beispiel: Wenn Essigsäure CH3COOH und Ethanol C2H5OH zu Wasser und dem Aromastoff Essigsäure-Ethylester CH3COO-C2H5 reagieren, dann verläuft die Reaktion nach folgender Reaktionsgleichung: CH3COOH + C2H5OH CH3COO-C2H5 + H2O.
5 Im chem. Gleichgewicht läuft die Hin- und Rückreaktion im Gemisch gleichschnell, es gilt das Massenwirkungsgesetz (MWG): Das Verhältnis aus dem Produkt der Konzentration cder Reaktionsprodukte zum Produkt der Ausgangsstoffkonzentrationen bleibt gleich (ist konstant; Symbol der Konstante: KMWG): c(Produkte) KMWG = c(Edukte)Beispiel:Für die Reaktion A + B AB gilt das MWG: c(AB) KMWG = c(A) x c(B)
Für die Reaktion „ Esterbildung “ (Gleichung: CH 3COOH + C 2H 5OH  CH 3COO-C 2H 5+ H 2O) ist das Verhältnis K MWG aus dem Produkt der Ester- und Wasserkonzentrationen c(Ester) • c(Wasser) und dem Produkt der Essigsäure- und Ethanolkonzentrationen c(Essigsäure) • c(Ethanol) bei konstanter Temperatur (hier: + 25°C) in dem Reaktionsgemisch stets gleichgroß:
CH 3COO-C 2H 5+ H 2O) ist das Verhältnis K MWG aus dem Produkt der Ester- und Wasserkonzentrationen c(Ester) • c(Wasser) und dem Produkt der Essigsäure- und Ethanolkonzentrationen c(Essigsäure) • c(Ethanol) bei konstanter Temperatur (hier: + 25°C) in dem Reaktionsgemisch stets gleichgroß:
c(Ester) • c(Wasser) K MWG = c(Essigsäure) • c(Ethanol) = 4 .
Für die Rückreaktion ( Spaltung des Esters in Essigsäure und Ethanol) ergibt sich der Kehrwert:
c(Essigsäure) • c(Ethanol)
K MWG = c(Ester) • c(Wasser) = 0,25 = ¼ .
1 In einem Lösungsgleichgewicht herrscht zwischen dem Bodensatz ungelösten Feststoffes MA und der gesättigter Lösung mit der Sättigungskonzentration der Ionen M+ und A- ein Gleichgewichtszustand. Das Löslichkeitsprodukt KL eines Salzes MA im Hinblick auf den Lösevorgang MA(s) M+(aq) + A-(aq) beträgt dann: KL(MA) = c(M+(aq)) x c(A-(aq)).
2 In einem Säure-Base-Gleichgewicht HA+H2O A- + H3O+ berechnet sich der pKs-Wert als Maß für die Säurestärke nach dem Massenwirkungsgesetz (bei c(H2O)=konst.) nach folgenden Gleichungen:
c(H 3O +) x c(A -) K S= c(HA) (Säurekonstante K S) und: pK S = - lg K S.
Hinweis: Je kleiner der pKs-Wert ist, desto stärker ist die Säure (vgl. Merksatz 84). Analog gibt es auch eine Basenkonstante K B und einen pK B -Wert für die Basenstärke.
1 Katalyse ist ein Vorgang, bei dem ein Stoff (Katalysator) eine chemische Reaktion ermöglicht oder beschleunigt, ohne selbst bei dieser Stoffumwandlung/Reaktion verbraucht zu werden (z.B. durch Erniedrigung der erforderlichen Aktivierungsenergie oder Verschiebung des chemischen Gleichgewichtes).
2 Die innere Energie Ueines stofflichen Systems besteht aus der thermischen Energie (ungerichtete Bewegung der Moleküle), der chemischen Bindungsenergie zwischen den Atomen (und den Wechselwirkungen mit elektrischen und magnetischen Dipolen) sowie der Potenziellen Energie der Atomkerne. Sie nimmt mit der Temperatur zu.
3 Die VolumenarbeitpVist die Arbeit W, die vom System gegen den Außendruck p verrichtet wird, um ein zusätzliches Volumen V einnehmen zu können.
Читать дальше

 CH 3COO-C 2H 5+ H 2O) ist das Verhältnis K MWG aus dem Produkt der Ester- und Wasserkonzentrationen c(Ester) • c(Wasser) und dem Produkt der Essigsäure- und Ethanolkonzentrationen c(Essigsäure) • c(Ethanol) bei konstanter Temperatur (hier: + 25°C) in dem Reaktionsgemisch stets gleichgroß:
CH 3COO-C 2H 5+ H 2O) ist das Verhältnis K MWG aus dem Produkt der Ester- und Wasserkonzentrationen c(Ester) • c(Wasser) und dem Produkt der Essigsäure- und Ethanolkonzentrationen c(Essigsäure) • c(Ethanol) bei konstanter Temperatur (hier: + 25°C) in dem Reaktionsgemisch stets gleichgroß:










