Typ 5 = Protonenaustausch („Protolyse“, Übertragung von H + -Teilchen oder Verdrängungs-Reaktion (Starke Säure verdrängt schwächere aus deren Salz), Typ 3 Neutralisation.
Reaktionsweisen von Basen:
1) Metalloxid + Wasser → Metallhydroxid (= Base; nur bei unedlen Metallen)
2) Base + Säure → Salz + Wasser (Neutralisation, Säure-/Base-Reaktion)
3) Starke Base + Salz der schwächeren Base → Schwächere Base + Salz stärkerer Base
Typ 1-3 sind Protonenübertragungen, Typ 3 zudem eine Verdrängungsreaktion.

 Abb.: pH-Papier zur Messung des pH-Wertes (links) und die Reaktion der Base Ammoniakgas NH 3 mit der Säuche Chlorwasserstoffgas HCl zu Ammoniumchlorid-Rauch NH 4Cl (rechts) (Eig. Fotos)
Abb.: pH-Papier zur Messung des pH-Wertes (links) und die Reaktion der Base Ammoniakgas NH 3 mit der Säuche Chlorwasserstoffgas HCl zu Ammoniumchlorid-Rauch NH 4Cl (rechts) (Eig. Fotos)
Redoxreaktionen (Elektronenaustausch)
1 Die Abgabe vonElektronen nennt man Oxidation (ox, auch der umgekehrte Vorgang ist u.U. möglich, Symbol dann: , s.u.!). Beispiele: Mg → Mg2+ + 2 e- 2 I-→ I2 + 2 e- Fe2+→ Fe3+ + e- H2→ 2 H+ + 2 e- S2-→ S + 2 e- SO32- + O2-→ SO42- + 2 e-MnO2 + 2 O2-→ MnO4- + 3 e-
2 Die Aufnahme von Elektronen nennt man Reduktion (red, Umkehrvorgang zur Oxidation). Beispiele: O2 + 4 e-→ 2 O2- Cl2 + 2 e-→ 2 Cl- H+ + e-→ H0 (atomar) Cu2+ + 2 e-→ Cu Fe3+ + e- → Fe2+ S + 2 e-→ S2- NO3- + e-→ NO2 + O2- NO3- + 2 e- → NO2- + O2-Mn2+ + 5 e- + 4 O2- → MnO4-
3 Bei Redoxreaktionen (red/ox) werden Elektronen e- ausgetauscht: Beispiele: ox: Li Li+ + e- (2x) Mg Mg2+ + 2 e- red: O + 2 e- O2- Cl + e- Cl- (2x).redox: 2 Li + O → Li2O Mg + 2 Cl → MgCl2 Deshalb ändern sich immer auch Ionenladungen oder Oxidationszahlen (das sind gedachte, rein rechnerische Oxidationszahlen, „hypothetische“ Ladungszahlen)!
4 Oxidationsmittel nehmen vom Partner e- auf, sie oxidieren ihn.Gute Oxidationsmittel sind die Elemente im PSE rechts oben, Edelmetall-Kationen und Elemente mit hohen Oxidationszahlen. Beispiele: F2, O2, Cl2, NO3-, SO42-, H2O2 (Peroxid mit O-1), Ag+, Cu2+, Mn4+ (in KMnO4),Cr6+ (in CrO42-und Cr2O72-), Pb4+ (in PbO2),gelegentlich auch H+.
5 Reduktionsmittel geben dem Partner e- ab, sie reduzieren ihn (und seine Ladungs-/ Oxidationszahl!), werden also selber oxidiert.Gute Reduktionsmittel sind die Elemente im PSE links und Elemente mit ungewöhnlich niedrigen Oxidationszahlen. Beispiele: H- (z.B. in LiH, NaH), H0 (atomar), Alkali- und Erdalkalimetalle, Al0, Zn0, Fe0 (und weitere unedle Metalle), Fe2+, H2, CH4, H2S, H2SO3, CO, C, HNO2
6 Reaktionsgleichungen für (kompliziertere) Redoxreaktionen erstellt man über die Teilgleichungen (red/ox). Beispiele:ox: Na Na+ + e- (2x) red: H2O + 2 e- H + OH- (2x)redox: 2 Na + 2 H2O → H2 + 2 NaOH
ox: Fe 2+Fe 3++ e -(5x) red: MnO 4 -+5e -+8 H +Mn 2++ 4 H 2O redox: 5 Fe 2+MnO 4 -+8 H + → 5 Fe 3++ Mn 2++ 4 H 2O
Hinweis: Bei jeder Redoxreaktion ändert sich die Oxidationszahl der Reaktionspartner. Die Oxidationszahl ist die gedachte Ladungszahl eines Atoms. Sie wird in anorganischen Verbindungen nach folgenden Regeln bestimmt:
Regeln zur Bestimmung der Oxidationszahlen:
Für Elemente / Elementverbindungen gilt die Oxidationszahl Null Beispiel: O2 Oxidationszahl O = 0 .
Alle Metalle haben immer positive Oxidationszahlen (als Elemente jedoch 0)
Fluor F hat die immer die Oxidationszahl -1 (es sei denn, es liegt elementar vor).
Wasserstoff H hat die Oxidationszahl +1 (als Element jedoch 0, in Metallhydriden –1).
Sauerstoff O hat die Oxidationszahl -2 (außer als Element, Peroxid oder Sauerstofffluorid).
Bor B und Silicium Si haben positive Oxidationszahlen (außer als Hydride).
Unter Rückgriff auf die bereits bekannten Oxidationszahlen von Elementen in einer Verbindung und Anwendung der o.g. Regeln lassen sich die unbekannten Oxidationszahlen weiterer Elemente in einer anorganischen Verbindung berechnen:
Die Summe der Oxidationszahlen ist: a) in einem Molekül gleich Null, b) in einem (Komplex-)Ion gleich der Ladung, die das (Komplex-)Ion nach außen trägt.
Bei den Ionenladungen geben die Ziffern die Anzahl der positiven bzw. negativen Ladungen an. Die Ionenladung einatomiger Ionen ist also deren Oxidationszahl.
 Abb.: Reaktion von konz. Salpetersäure HNO 3 mit Kupfer zu braunen Stickoxiden NO 2 und grünem Kupfernitrat (eig. Foto)
Abb.: Reaktion von konz. Salpetersäure HNO 3 mit Kupfer zu braunen Stickoxiden NO 2 und grünem Kupfernitrat (eig. Foto)
1 Eine Disproportionierung ist eine Redoxreaktion eines Atoms mittlerer Oxidationszahl in eine Verbindung mit höherer und eine Verbindung mit niedrigerer Oxidationszahl; eine Komproportionierung ist die Redoxreaktion zweier Verbindungen eines Elementes zu einer Verbindung des Elementes mit mittlerer Oxidationszahl.
2 Kationen edlerer Metalle reagieren mit unedleren Metallen zum edleren Metall und zum Kation unedlerer Metalle (Spannungsreihe der Metalle).Beispiel: Mg + CuSO4 → Cu + MgSO4
3 Ein galvanisches Element ist eine Anordnung aus zwei Elektroden unterschiedlicher Metalle in einem Elektrolyten, die eine elektrische Spannung aufbaut.
Beispiel: Ein Zink- und ein Kupferstab tauchen in verdünnte Schwefelsäure oder in die Lösung ihres jeweiligen Salzes, die über eine Elektrolytlösung als Strombrücke verbunden sind. Zwischen den Elektronen Cu/Zn baut sich eine elektrische Spannung auf:
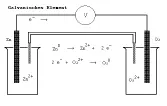
1 Das elektrochemisch messbare Redoxpotenzial in Volt V gibt Auskunft darüber, wie stark ein Oxidationsmittel ist. Es wird in galvanischen Elementen gegen die Normalwasserstoffelektrode NWE gemessen: 2 H+ + 2 e- H2 mit ENWE = 0,00 V.
2 Das Redoxpotential der Halbzelleeines galvanischen Elementes gibt an, wie groß das Bestreben einer Halbzelle ist, Elektronen aufzunehmen oder abzugeben (im Vgl. zur „Normal“-Halbzelle Wasserstoff/Säure; elektrochemische Energie)
3 Die Elektromotorische Kraft (EMK) ist die Fähigkeit eines Systems (einer Halbzelle eines galvanischen Elementes), durch Elektronenfluss (Abgabe von elektr. Energie) Arbeit zu leisten.
4 Die Normalwasserstoffelektrode (NWE) ist eine Wasserstoff/Säure-Halbzelle unter Normalbedingungen (p=1013 hPa, T= 293 K, c= 1 mol/L).
5 Eine Elektrolyse ist eine (von außen mit Hilfe von Strom) erzwungene Redoxreaktion (z.B. Zerlegung einer Substanz mit Hilfe von Gleichstrom).
Grundwissen zu Komplexen und ihren koordinativen Bindungen
1 Komplexe entstehen durch den Austausch von Elektronenpaaren zwischen einem Zentralatom und einem oder mehreren Liganden, die sich geometrisch um das Zentralatom herum anordnen (Koordination).
 Abb.: Komplexe sind oft farbig – Lösungen komplexer Verbindungen (eig. Foto)
Abb.: Komplexe sind oft farbig – Lösungen komplexer Verbindungen (eig. Foto)
1 Zentralatome sind Kationen oder Metallatome mit freier, innerer „Elektronenlücke (zumeist Nebengruppenelemente, diese haben freie 3d- und 4dOrbitale), Beispiele:Cu2+, Ag+, Fe2+, Fe3+, Cr3+, Co2+, Ni2+, aber auch Ni, Pb2+, Bi3+ u.a.
Читать дальше

 Abb.: pH-Papier zur Messung des pH-Wertes (links) und die Reaktion der Base Ammoniakgas NH 3 mit der Säuche Chlorwasserstoffgas HCl zu Ammoniumchlorid-Rauch NH 4Cl (rechts) (Eig. Fotos)
Abb.: pH-Papier zur Messung des pH-Wertes (links) und die Reaktion der Base Ammoniakgas NH 3 mit der Säuche Chlorwasserstoffgas HCl zu Ammoniumchlorid-Rauch NH 4Cl (rechts) (Eig. Fotos) Abb.: Reaktion von konz. Salpetersäure HNO 3 mit Kupfer zu braunen Stickoxiden NO 2 und grünem Kupfernitrat (eig. Foto)
Abb.: Reaktion von konz. Salpetersäure HNO 3 mit Kupfer zu braunen Stickoxiden NO 2 und grünem Kupfernitrat (eig. Foto)
 Abb.: Komplexe sind oft farbig – Lösungen komplexer Verbindungen (eig. Foto)
Abb.: Komplexe sind oft farbig – Lösungen komplexer Verbindungen (eig. Foto)










