
Abbildung: Ionenkristalle weisen stoffspezifische Formen auf: Natriumchlorid kristallisiert immer würferlförmig, Kalziumfuorid (Flussspat) in oktaedern und wieder andere Mineralien in Doppelspat- oder Oktaeder-Form (eig. Foto)

Abbildung: Metall-Nichtmetall-Verbindungen sind stets salzartig (ionisch): kristallkin und nicht verformbar (spröde, brüchig), von hoher Schmelztemperatur und elektrisch leitfähig nur in Lösung und Schmelze. Iim Foto: Sulfide der Elemente Eisen, Zink, Molybdän und Quecksilber (FeS 2, ZnS, MoS 2, rechts HgS), mittig auch Quecksilberoxid (HgO) und Quecksilberchlorid (HgCl 2).
1 Nichtmetallatome reagierenuntereinander so, dass sie danach ihre Außenelektronen gemeinsam als bindende Elektronenpaare (Elektronenpaarbindung EPB, auch: „Atombindung“) nutzen, denn die Nichtmetallatome streben dabei eine Edelgaskonfiguration an (maximal 4 Elektronenpaare, d.h. volle Außenschale mit 2 bzw. 8 Elektronen). Beispiel: Cl + e- → Cl- (Chlorid-Anion) Weiteres Beispiel: Zwei Wasserstoffatome H vereinigen sich zu einem Wasserstoffmolekül H2, indem sie ihre beiden Elektronen gemeinsam benutzen (bindendes Elektronenpaar): H + H → H2 bzw.: H + H → H – H (bzw. H2) (Punkt = einzelnes Valenzelektron, Bindestrich = bindendes Elektronenpaar). Abbildung: H2-Molekül (Bildquelle: https://de.wikibooks.org/wiki/Datei:Schema_Wasserstoffmolek%C3%BCl.svg , gemeinfrei)
2 Moleküle sind elektrisch neutrale Atomverbände. Die Atome sind über bindende Elektronenpaare miteinander verbunden.
3 Molekulare Verbindungen sind allesamt elektrische Nichtleiter (Isolatoren). Verbindungen mit kleinen Molekülen sind flüchtig (niedriger Siedepunkt), Verbindungen mit sehr großen Molekülen kunststoff- oder diamantartig (zersetzlich oder hoher Schmelzpunkt).
4 Moleküle können unpolar sein (gleiche Aufteilung des bindenden Elektronenpaares auf beide Bindungspartner) oder polar (ungleiche Aufteilung, Ausbildung von Plus- und Minuspol, so dass das Molekül zum Dipol wird; Folge: höhere Anziehungskräfte zwischen den Molekülen, somit z.B. höhere Schmelz- und Siedetemperaturen). Beispiele: Die Moleküle von Wasserstoff, Chlor und Methangas sind unpolar (gleiche Bindungspartner / symmetrischer Aufbau). Cl∙+ ∙Cl → Cl-Cl (Chlormolekül) Methangasmolekül:CH4 :
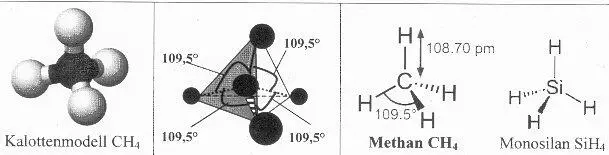
Die Moleküle von Chlorwasserstoffgas und Wasser sind polar (Chlor- und Sauerstoffatom ziehen das bindende Elektronenpaar stärker an als die Wasserstoffatome): Wasser H 2O: H – O – H
Bildquellen: HCl-Bildung: Von Sundance Raphael 16:18, 16. Nov. 2006 (CET) - "own work", https://de.wikibooks.org/w/index.php?curid=34621, Sauerstoffmolekül: https://de.wikibooks.org/wiki/Datei:Sauerstoff_Elektronenschreibweise.svg, Chlormolekül: https://de.wikibooks.org/wiki/Anorganische_Chemie_f%C3%BCr_Sch%C3%BCler/_Die_Atombindung#/media/File:Chlor_Elektronenschreibweise.svg, CH 4-Molekül unten rechts: https://de.wikibooks.org/wiki/Datei:Methan_Elektronenschreibweise.svg)
1 Die Elektronegativität (EN) ist dieKraft, mit der ein Atom in einer Bindung das bindende Elektronenpaar anzieht.
2 Die EN ist im PSE bei Fluor- und Sauerstoffatomen am höchsten. Mit zunehmendem Abstand des Elementes im PSE vom Fluor sinkt die EN ab.
3 Elektropositivsind Atome mit geringer Elektronegativität (hohe EN-Differenz: ionische Bindung, Differenz an EN ≈0: unpolar). Besonders elektropositiv sind die Atome unedler Metalle (rechts im PSE stehend).
4 Es gibt drei wichtige Arten der chemischen Bindung: Ionenbindung (hohe EN-Differenz der Bindungspartner), Atombindung (geringe EN-Differenz) und die metallische Bindung (in Legierungen). Beispiele: Chlorgas, Natriumchlorid und Natrium-Kalium-Legierungen:
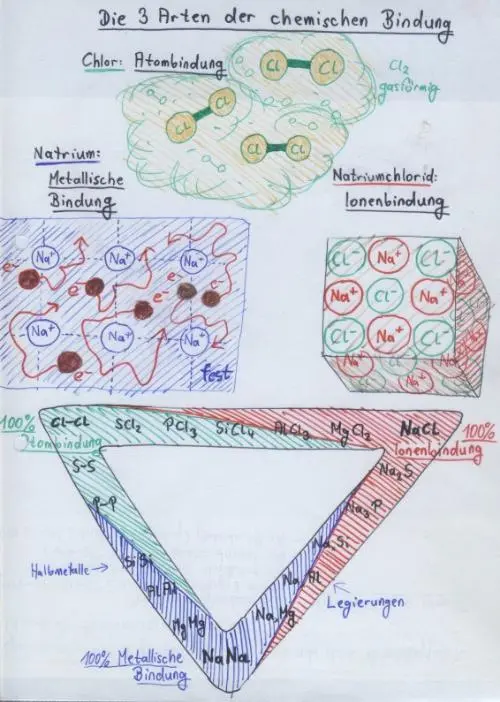 (Bildquelle: Eigenes Werk, ebenso die folgende Abbildung)
(Bildquelle: Eigenes Werk, ebenso die folgende Abbildung)
1 Atommodelle versuchen, den Aufbau der Atome zu beschreiben – die chemische Bindung zwischen ihnen wird in Bindungsmodellen beschrieben.
Hinweise:
Fachbegriffe aus den Atommodellen neben Atom, Ion und Molekül sind Elementarteilchen und Isotop :
Elementarteilchen sind Bestandteile eines Atoms (Proton p + und Neutron n im Atomkern, Elektronen e - in der Atomhülle).
Isotope sind Atome eines Elementes (also mit gleicher Protonenzahl) aber von unterschiedlicher Neutronenzahl (also ungleicher Neutronenzahl).
Die Atomhülle ist der fast masselose Bereich des Atoms um den Atomkern. Hier halten sich die Elektronen auf (in Schalen / Orbitalen).
Fachbegriffe aus den Bindungsmodellen neben Elektronegativität und chemischer Bindung sind Orbitale und Hybridisierung .
Orbitalmodell und MO-Theorie
1 Die Orbitaltheorie beschreibt den Aufenthaltsbereich der Elektronen in der Atomhülle anders als das Bohr’sches Atommodell nicht auf „Bahnen“ und in „Schalen“, sondern „wellenmechanisch“ in Räumen erhöhter Aufenthaltswahrscheinlichkeit. Elektronen sind hier nicht nur „Teilchen“ sondern auch „stehende Wellen“, die sich in diesen Orbitalen aufhalten.
2 Vereinfachtes Orbitalmodell: Die Elektronen halten sich im Atom nicht auf Bahnen, sondern in Kugelwolken auf – jeweils zwei in einer Kugelwolke („Elektronenpaare“) und je „Schale“ gibt es vier Kugelwolken („Elektronenoktett“).
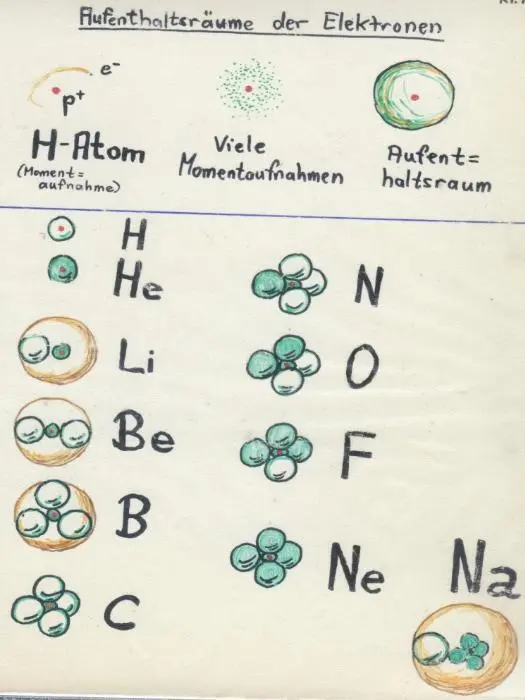 Kugelwolkenmodell: Das Elektron befindet sich nicht auf einer festen Bahn, sondern hält sich im Atom mit einer bestimmten Wahrscheinlichkeit in einem zumeist kugelförmigen Raum auf (dem Orbital, der Kugelwolke). Ein zweites Elektron kann hinzukommen, dann aber ist der Aufenthaltsraum voll, ein neuer Aufenthaltsraum wird aufgefüllt. Immer wenn vier Aufenthaltsräume voll sind, geht das nachfolgend aufgefüllte Elektron in einen neuen, leeren Aufenthaltsraum, der eine Schale weiter vom Kern entfernt liegt.
Kugelwolkenmodell: Das Elektron befindet sich nicht auf einer festen Bahn, sondern hält sich im Atom mit einer bestimmten Wahrscheinlichkeit in einem zumeist kugelförmigen Raum auf (dem Orbital, der Kugelwolke). Ein zweites Elektron kann hinzukommen, dann aber ist der Aufenthaltsraum voll, ein neuer Aufenthaltsraum wird aufgefüllt. Immer wenn vier Aufenthaltsräume voll sind, geht das nachfolgend aufgefüllte Elektron in einen neuen, leeren Aufenthaltsraum, der eine Schale weiter vom Kern entfernt liegt.
1 Ein Atomorbital (AO) ist der Aufenthaltsbereich eines Elektrons oder Elektronenpaares in einem Einzelatom(s-,p-,d-,f-Orbital: kugel-, hantel-, doppelhantelförmig usw.). Beispiel: In der innersten und zweitinnersten „Schale“ (1. Energieniveau) existieren kugelförmige s-Atomorbitale (1s, 2s) und in der zweitinnersten Schale (2. Energieniveau) existieren entlang der x-, y- und z-Achse je ein hantelförmiges p-Orbital (2px, 2py, 2pz): Bildquelle: Gemeinfrei, unter https://de.wikipedia.org/wiki/Datei:AOs-3D-dots.pngAbbildung: Computergenerierte Darstellung der Wahrscheinlichkeitsdichte des 1s-Orbitals mithilfe einer (sehr feinen) Punktwolke Bildquelle: R.J.Hall, wikimedia commons, über: https://de.wikipedia.org/wiki/Datei:Orbital_s1.png(GNU-Lizenz für freie Dokumentation)
Читать дальше



 (Bildquelle: Eigenes Werk, ebenso die folgende Abbildung)
(Bildquelle: Eigenes Werk, ebenso die folgende Abbildung) Kugelwolkenmodell: Das Elektron befindet sich nicht auf einer festen Bahn, sondern hält sich im Atom mit einer bestimmten Wahrscheinlichkeit in einem zumeist kugelförmigen Raum auf (dem Orbital, der Kugelwolke). Ein zweites Elektron kann hinzukommen, dann aber ist der Aufenthaltsraum voll, ein neuer Aufenthaltsraum wird aufgefüllt. Immer wenn vier Aufenthaltsräume voll sind, geht das nachfolgend aufgefüllte Elektron in einen neuen, leeren Aufenthaltsraum, der eine Schale weiter vom Kern entfernt liegt.
Kugelwolkenmodell: Das Elektron befindet sich nicht auf einer festen Bahn, sondern hält sich im Atom mit einer bestimmten Wahrscheinlichkeit in einem zumeist kugelförmigen Raum auf (dem Orbital, der Kugelwolke). Ein zweites Elektron kann hinzukommen, dann aber ist der Aufenthaltsraum voll, ein neuer Aufenthaltsraum wird aufgefüllt. Immer wenn vier Aufenthaltsräume voll sind, geht das nachfolgend aufgefüllte Elektron in einen neuen, leeren Aufenthaltsraum, der eine Schale weiter vom Kern entfernt liegt.










