1 Elementare Gase sind zweiatomig (Ausnahme: Edelgase), da sich ihre Atome miteinander verbinden. Beispiele: Sauerstoff O2, Chlor Cl2, Wasserstoff H2, Iod(dampf) I2, Stickstoff N2.
2 Formeln enthalten kleine, tiefgestellte Zahlen für die Anzahl der Atome im Molekül oder die Mengenverhältnisse der Ionen im Salzkristall. Man bildet sie aus den Namen der Verbindungen nach oben genannten Regeln: Elementsymbole für die Element-Namen einsetzen und kleine, tiefgestellte Zahlen für die Stoffmengenverhältnisse der Elemente in dieser Verbindung. Hinweis: Dabei müssen Ionenladungen in Salzen immer ausgeglichen werden (Gesamtladung Null), denn Kationen und Anionen bilden nur neutrale Salzkristalle. Beispiel: Al2O3 (aus 2 Al3+und 3 O2-, kgV = 6)
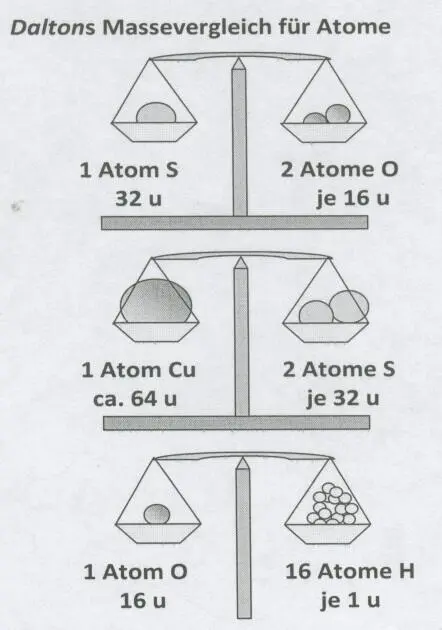 |
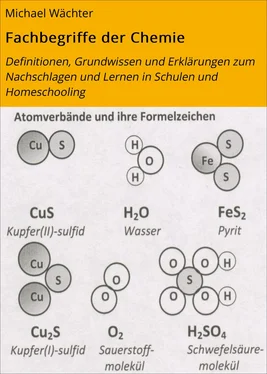
Abbildungen:Über die Atomzahlenverhältnisse in den Atomverbänden und die Formeln sind Vergleiche der Masse der Atome möglich. So kommt man auf die Größen „Masse“ und „Stoffmenge“ (vgl. Grundgesetze der Chemie, Kapitel 3, undv Grundwissen zur Physikalischen Chemie, Kap. 13; Bildquelle: eig. Werk ). |
1 Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.Große Zahlen geben Stoffmengenverhältnisse an, also dass man mehrere Teilchen bestimmter Stoffe (Formeln) braucht.
Beispiel: Bei der Knallgasreaktion (Merksatz Nr. ) verbinden sich Wasserstoff H 2 und Sauerstoff O 2 im Volumen- und Stoffmengenverhältnis 2 : 1zu Wasserdampf H 2O: Wasserstoff + Sauerstoff Wasser(stoffoxid) Aus zwei Litern Wasserstoffgas und 1 Liter Sauerstoffgas werden nach der Explosion und Abkühlung (ohne Kondensation zu flüssigem Wasser) ziemlich genau zwei Liter Wasserdampf.Die Reaktionsgleichung in Formeln ist: 2 H 2+ O 2 2 H 2O (und nicht : 2 H 2+ O 2 H 2O).
Diese Gleichung 2 H 2+ O 2 2 H 2O sagt aus: 2 Mol H 2 + 1 Mol O 2 2 Mol H 2 O 2 Liter H 2 -Gas + 1 Liter O 2 -Gas 2 Liter H 2 O-Dampf (Gas)2 Moleküle H 2 + 1 Molekül O 2 2 Moleküle H 2 O
In ähnlichem Stoffmengenverhältnis reagieren z.B. auch Kupfer Cu und Schwefel S zu Kupfer(I)-sulfid CuS: 2 Mol Cu + 1 Mol S 1 Mol Cu 2S . Hier entsteht jedoch nur 1 Mol Produkt – und nicht zwei Moleküle wie bei der Knallgasreaktion. Daraus folgerte der Chemiker Avogadro , dass elementare Gase zweiatomig vorkommen (molekular) – so entdeckte er die „Moleküle“ (vgl. folgende Seite: Gleiche Volumina an Gasen enthalten gleiche Stoffmengen bzw. Anzahlen an Molekülen!).
Erinnerung: Dieses folgt u.a. aus den vorherigen Grundsätzen:Wenn sich Stoffe umwandeln, so reagieren sie chemisch. Chemische Reaktionen sind Vorgänge, bei denen mindestens ein neuer Stoff entsteht (erkennbar an neu auftretenden Stoffeigenschaften). Reaktionsgleichungen geben die (Formeln der) Ausgangsstoffe und (der) Endstoffe wieder.
Elemente bestehen aus Atomen (kleinstmögliche Stoffportionen der Elemente). Bei Reaktionen bilden sie Verbindungen (Teilchen-Umgruppierung), d.h. die Atome der Elemente bilden Atomverbände aus Ionen oder Molekülen (Verbände aus Atomen gleicher Elektronegativität bilden neutrale Verbände.
Beispiele für Moleküle und ihre Formeln: Sauerstoff O 2 , Chlor Cl 2 , Iod I 2 , Hexan C 6H 14 , Schwefelpulver S 8 usw.). weitere Beispiele für Reaktionsgleichungen: Kupfer + Schwefel Kupfer(II)-sulfid Cu + S CuS (Stoffmengenverhältnis Cu : S = 1:1) Kupfer + Schwefel Kupfer(I)-sulfid 2 Cu + S Cu 2S (Stoffmengenverhältnis Cu : S = 2:1) Aluminium + Sauerstoff Aluminiumoxid 4 Al + 3 O 2 2 Al 2O 3 (Verhältnis Al : O = 2 : 3)

Grundwissen zu Atomen und Bindungen
1 Atome weisen im Kern neutrale Teilchen auf (Neutronen, Symbol: n) sowie positiv geladene Teilchen, die Protonen (Symbol: p+). In der Atomhülle befinden sich negativ geladene Elektronen (Symbol: e-, im Vergleich zum Atomkern fast masselos; Rutherford‘sches Atommodell).
2 Die Elektronen befinden sich in der Atomhülle auf verschiedenen Bahnen (Umlaufbahnen, von innen nach außen mit K, L, M, N, … bezeichnet; Bohr’sches Atommodell, inzwischen „überholt“).
3 Metalle sind Elemente. Sie sind allesamt Stoffe a) mit hoher elektrischer Leitfähigkeit, b) verformbar, c) glänzend und d) sehr gute Wärmeleiter, weil ihre Atome wenig Außenelektronenhaben (und diese sind recht „locker“ an den Kern gebunden und daher frei beweglich).
4 Neutrale Atome haben immer gleiche Protonen- und Elektronenzahlen (Ihre Neutronenzahl berechnet sich aus der Differenz der relativen Atommasse zur Ordnungs- bzw. Protonenzahl). Ionen sind elektrisch geladene Atome: Die Anzahl ihrer Elektronen entspricht nicht der Anzahl der Protonen im Kern.
5 Ionen sind elektrisch geladene Atome oder Atomverbände (Kationen positiv, Elektronenzahl ist kleiner als die Anzahl der Protonen im Atomkern; Anionen negativ, Elektronenzahl ist größer als die Anzahl der Protonen). Beispiele für Ionen: Mg2+, Cl-, S2-, Al3+, SO42-, CH3COO-
6 Im Periodensystem der Elemente (PSE) sind die Atome in der Reihenfolge ihrer Protonenzahl (im Kern) angeordnet. Nach jedem Edelgasatom (volle Außenschale) beginnt eine neue Zeile (Periode), da das Atom eine Schale hinzubekommt (Bohr’sches Atommodell). Atome von Elementen, die in einer Spalte (Hauptgruppe) untereinander stehen, weisen daher die gleiche Anzahl von Außenelektronen auf.
7
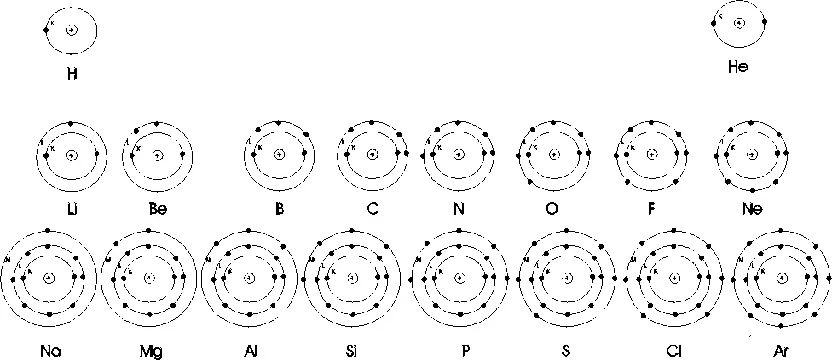
1 Edelgaskonfiguration: Alle Atome streben bei chemischen Reaktionen in ihrer Hülle eine volle Außenschale an (mit 2 bzw. 8 Außenelektronen). Beispiel: Die Edelgasatome (Elemente der 8. Hauptgruppe im Periodensystem) haben stets 8 Außenelektronen (vgl. Bild oben: Ne, Ar; Ausnahme: Helium). Die Atome der 7. Hauptgruppe (Halogen-Atome) haben 7 Außenelektronen. Sie sind daher bestrebt, bei chemischen Reaktionen noch je ein Elektron aufzunehmen. Cl + e-→ Cl-
2 Atome verbinden sich mit anderen Atomen über die Außenelektronen in ihrer Atomhülle.
3 Metallatome reagieren mit Nichtmetallatomen, indem sie Elektronen an diese abgeben (Elektronenübertragung, Redoxreaktion), sie werden durch die Ladungstrennung elektrisch positiv geladen (Ionenbildung durch Oxidation = Elektronenabgabe), Beispiel: Mg → Mg2+ + 2 e-
4 Nichtmetallatome reagierenmit Metallatomen, indem sie bei chem. Reaktionen von ihnen Elektronen aufnehmen (Bildung der Anionen durch Reduktion = Elektronenaufnahme).Anders ausgedrückt: Verbindungen aus Metallatomen mit Nichtmetallatomen entstehen, indem Metallatome ihre Außenelektronen an Nichtmetallatome abgeben, es entstehen salzartige Verbindungen (Ionenbindungen).
5 Salze sind allesamt ionische Verbindungen: Sie sind a) spröde (brüchig), b) weisen sehr hohe Schmelzpunkte auf und sind c) nur in Lösung oder Schmelze elektrisch leitfähig. Der Grund für ihre Eigenschaften liegt darin, dass sie aus Kationen und Anionen bestehen, die sich elektrisch anziehen und unter Abgabe von Energie zu Ionenkristallen vereinigen. Beispiele:Kochsalz NaCl, Magnesiumchlorid MgCl2Reaktionsbeispiel:Chlorgas reagiert mit dem Metall Natrium, indem jedes Na-Atom sein Außenelektron an ein Chloratom abgibt: Reaktionsverlauf: Na → Na+ + e- (Oxidation, Kation entsteht), Cl + e- → Cl- (Reduktion,Anion entsteht) Na + Cl → Na+ + Cl- (Redox, NaCl-Kristall entsteht) auch als: Na + Cl → Na+ + :Cl-
Читать дальше