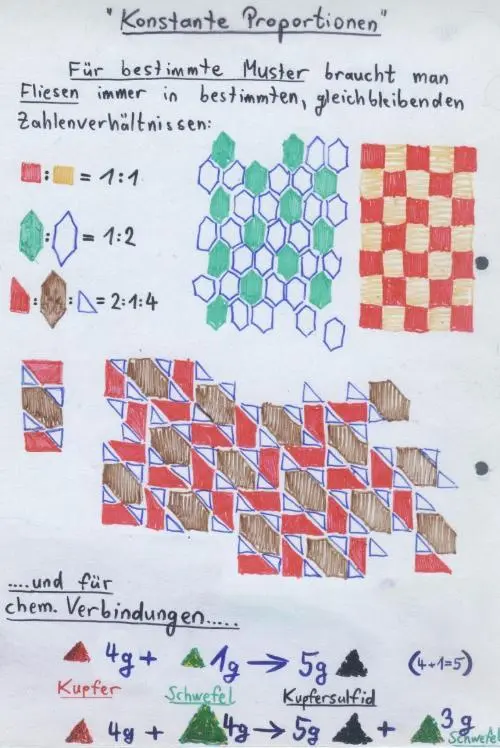
2 Chemische Verbindungen entstehen aus Elementen oder deren Verbindungen immer nur in ganz bestimmten, gleichbleibenden Masseverhältnissen (Gesetz der konstanten Proportionen, 2. Grundgesetz der Chemie).Beispiel: Kupfer und Schwefel verbinden sich zu schwarzblauem Kupfer(I)-sulfid immer ziemlich genau im Masseverhältnis m (Kupfer) : m(Schwefel) = 4 : 1
Wenn also 5 g Kupfer (Symbol: Cu) und 1 g Schwefel zur Reaktion gebracht werden, dann bleibt 1 g Kupfer Cu übrig. Bei der Reaktion von 4 g Kupfer und 4 g Schwefel entstehen 5 g Kupfer(I)-sulfid und 3 g Schwefel bleiben übrig (Symbol: S; oder die 3 g S bzw. Schwefel verbrennen an Luft zu Schwefeldioxid-Gas); weitere Beispiele hierzu:
5 g Kupfer + 1 g Schwefel → 5 g Kupfer(I)-sulfid + 1 g Kupfer4 g Kupfer + 4 g Schwefel (S) → 5 g Kupfer(I)-sulfid + 3 g S 8 g Kupfer + 1 g S → 5 g Kupfer(I)-sulfid + 4 g Kupfer 1 kg Kupfer + 1 kg S → 1,25 kg Kupfer(I)-sulfid +750 kg S10 mg Kupfer + 12,5 mg S → 12,5 mg Kupfer(I)-sulfid + 10 mg S.

1 Kupfer(I)-sulfid enthält die Elemente Kupfer (Symbol: Cu) und Schwefel (Symbol: S) also immer im Masseverhältnis 4 : 1, d.h.: m (Cu) : m(S) = 4 : 1
2 Wenn zwei Elemente miteinander mehrere Verbindungen bilden können, dann stehen deren Masseverhältnisse immer im Verhältnis kleiner, ganzer Zahlen zueinander (Gesetz der multiplen Proportionen).Beispiel: Kupfer Cu und Schwefel S bilden miteinander schwarzblaues Kupfer(I)-sulfid. Es gibt aber auch eine tiefschwarze Kupfer-Schwefel-Verbindung, das Kupfer(II)-sulfid. Es enthält die Elemente Kupfer Cu und Schwefel S immer im Massenverhältnis m (Cu) : m(S) = 2 : 1. In den beiden Verbindungen verhalten sich die Massenanteile von Kupfer Cu also zueinander genau wie 4 : 2 bzw. 2 : 1: m(Cu in Kupfer(I)-sulfid) : m(Cu in Kupfer(II)-sulfid) = 2 : 1.
3 Aus dem Gesetz der multiplen Proportionen (dem Verhältnis kleiner, ganzer Zahlen) folgt, dass chemische Verbindungen und Elemente aus kleinsten, unteilbaren Stoffportionen oder Einheiten bestehen – den Atomen (Atomhypothese von Dalton). Beispiel: Es ist mit Verbindungen ähnlich wie Kachelmustern: Auch sie bestehen aus einzelnen Kacheln in ganz bestimmten Mengenverhältnissen. Für jedes Muster ist das Mengenverhältnis unterschiedlich – genau wie bei chemischen Verbindungen (denn Kachelmuster und Verbindungen bestehen beide aus kleinsten Einheiten).
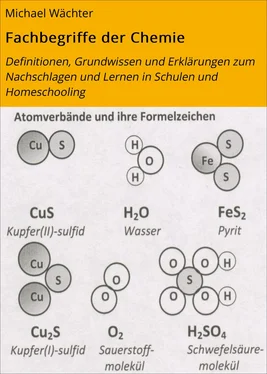
Grundwissen zu Teilchen und Arten chemischer Verbindungen
1 Chemisch unzerlegbare Reinstoffe (Elemente) werden mit Elementsymbolen abgekürzt. Beispiele: Die international festgelegten Symbole der zwölf wichtigsten chemischen Elemente (je 6 Metalle und Nichtmetalle) sind:
Wasserstoff H Kohlenstoff CSauerstoff O Stickstoff NChlor Cl Schwefel SEisen Fe Aluminium AlKupfer Cu Magnesium MgSilber Ag Natrium Na
1 Metalle sind glänzend, verformbar, elektrisch leitend und gute Wärmeleiter. Nichtmetalle leiten den elektrischen Strom nicht (Isolatoren, Nichtleiter).
2 Die kleinstmöglichen Stoffportionen der Elemente sind die Atome. Alle Atome eines Elementes haben annähernd die gleiche Masse. Sie bestehen aus einem Kern und einer Hülle, in der sich negative Ladungen befinden – die Elektronen.
3 Wenn Elemente Verbindungen bilden, dann vereinigen sich die Atome dieser Elemente zu Atomverbänden (z.B. zu Molekülen). Diese Atomverbände sind die kleinstmöglichen Stoffportionen chemischer Verbindungen.
4 Unabhängig von der Masse von chemisch reagierenden Stoffportionen sind bestimmte Mengen von Stoffen einander chemisch gleichwertig.
5 Die Masse m einer Stoffportion (abgewogen in Gramm, g, oder Kilogramm, kg) entspricht deshalb nicht ihrer Stoffmenge n (angegeben in Mol). Vergleichsbeispiel: Auch eine Menge von 10 Menschen hat nicht immer die gleiche Masse, denn 10 Säuglinge wiegen weniger als 10 Sumo-Ringer.
6 Aus den chemischen Grundgesetzen (Merksätze Nr. 11-13) und der Atomhypothese von Dalton folgt: Chemisch zerlegbare Reinstoffe (Verbindungen) bilden sich aus ihren Elementen auch immer nur in bestimmten Mengenverhältnissen. Beispiele:Die beiden Reaktionen Kupfer + Schwefel → Kupfersulfid zu den beiden Verbindungen Kupfer(I)-sulfid und Kupfer(II)-sulfid verlaufen in folgenden Stoffmengen-Verhältnissen Cu : S = 2:1 (Produkt: Kupfer(I)-sulfid) und Cu : S = 1:1 (Produkt Kupfer(II)-sulfid).
7 a) Verbindungen von Metallen mit Nichtmetallen sind Salze (ionische Verbindungen), b) Verbindungen von Metallen mit Metallen sind Legierungen (metallische Verbindungen) c) Verbindungen von Nichtmetallen mit Nichtmetallen sind molekulare Verbindungen:
Metall + Nichtmetall → Salz
Metall + Metall → Legierung
Nichtmetall + Nichtmetall → molekulare Verbindung.
Beispiele: Kochsalz (Natriumchlorid NaCl) ist eine chemische Verbindung aus dem Leichtmetall Natrium Na und dem grünen Giftgas Chlor: Natrium Na + Chlor Cl → Natriumchlorid NaCl.
Das gelbglänzende Messing ist eine Verbindung (Legierung) aus dem rotglänzenden Kupfer und aus Zink. Wasser ist chemisch zerlegbar in brennbares Wasserstoffgas und brandförderndes Sauerstoffgas. Das Gemisch aus beiden Gasen ist explosiv (Knallgas) und reagiert zu Wasserdampf – am heftigsten im Verhältnis 2 : 1; Reaktionsschema hier: Wasserstoff H + Sauerstoff O → Wasser H 2 O
1 Wenn Metalle chemisch reagieren (sich mit anderen Stoffen vereinigen / verbinden), dann geben ihre Atome die äußeren Elektronen aus der Atomhülle ab. Die Anzahl der Außenelektronen entspricht der Hauptgruppen-Nummer im Periodensystem (PSE), der Tabelle der chemischen Elemente.
2 Bei dieser Elektronenabgabe (Oxidation, ox) entstehen aus Metallatomen immer Kationen (positiv geladene Atomteilchen), die Ionenladung entspricht der Hauptgruppenzahl im PSE; bei Nebengruppen wird die Ionenladung als römische Ziffer in Klammern angegeben: Beispiele: Li → Li+ + e- Mg → Mg2+ + 2 e- Cu → Cu2+ + 2 e-[Kupfer(II)-Kation]
3 Nichtmetall-Atome nehmen ein oder mehrere Elektronen auf (Reduktion, red). Sie werden zu Anionen (negativ geladene Teilchen). Die Anzahl ihrer negativen Ladungen entspricht der Hauptgruppenzahl minus acht: Beispiele: Cl + e-→ Cl- Hauptgruppe VII O + 2 e-→ O2- S + 2 e-→ S2- Hauptgruppe VI (rechne hier: VI – 8 = -2; Namen: Oxid-, Chlorid-, Sulfid-Anion)
Namen und Formeln chemischer Verbindungen
1 Namen von Salzen aus zwei Elementen bestehen aus dem Metall-Name, ggf. mit Ionenladung, dem Nichtmetall-Namen (oft in lateinischer Form) und der Endung –id Beispiele: Magnesiumoxid MgO, Natriumchlorid NaCl, Natriumoxid Na2O, Kupfer(I)-sulfid Cu2S, Kupfer(II)-sulfid CuS,Eisen(III)-oxid Fe2O3
Achtung: Wenn Sauerstoff als drittes Element hinzukommt und sich mit dem Nichtmetall verbindet, dann endet der Name auf –at.
Beispiele: Natriumsulf at Na 2SO 4, Kalziumcarbon at CaCO 3
1 Namen von molekularen Verbindungen aus zwei Elementen werden gebildet aus dem Namen des Nichtmetalles, das im PSE weiter links oder weiter unten steht, und dem Namen des zweiten Nichtmetalles (im PSE weiter rechts oder oben). Davor kommt jeweils eine Zahlsilbe für das Mengenverhältnis (siehe Formel): mono = 1, di = 2, tri = 3, tetra = 4, penta = 5, hexa = 6, hepta = 7.
Beispiele: (Mono-)Kohlen(stoff) mon oxid CO ( giftig! ), (Mono-)Kohlen(stoff) di oxid CO 2, Di stickstoff tri oxid N 2O 3, Di stickstoff mon oxid N 2O (Lachgas), Kohlenstoff tetra chlorid CCl 4, Schwefel hexa fluorid SF 6‘
Читать дальше