1 ...6 7 8 10 11 12 ...16 1 Liganden sind Moleküle oder Anionen, die freie Elektronenpaare zur Verfügung stellen können.
Beispiele: NH 3( Name als Ligand: -ammin-), H 2O (-aquo-), CO (-carbonyl-), NO (-nitrosyl-), F -, Cl -, Br -, I -(-fluoro-, -chloro- usw.), CN -, SCN -(-cyano-, -thiocyano-) , OH -(-hydroxo-), O 2-(-oxo-), S 2-(-thio- / -sulfo-), S 2O 2 2-(-thiosulfato-) usw., aber auch große Moleküle wie EDTA, Eiweiße u.a.
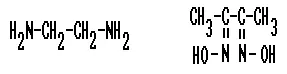
Ethylendiamin (ED) Dimethylglyoxim (DMG)
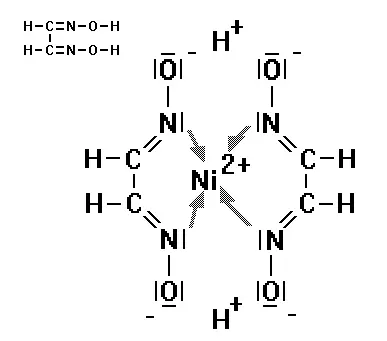
Auch die Verbindungen Ethylendiamin (links, am Stickstoffatom sitzt jeweils ein freies Elektronenpaar) und D i m ethyl g lyoxim ( DMG , rechts, hier sitzen freie Elektronenpaare an den beiden Stickstoffatomen) sind gute Komplexbildner. DMG bindet sich z.B. an Ni 2+ -Ionen (himbeerroter Niederschlag von Nickel-DMG):
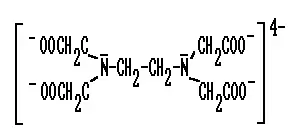
Das Molekül der Verbindung Ethylendiamintetraacetat (EDTA, "Komplexon") weist sogar 6 Koordinationsstellen auf, mit denen es über jeweils ein freies Elektronenpaar ein Metall-Kation binden kann (an jedem der vier negativ geladenen O-Atome und an jedem der zwei N-Atome):
1 Komplexe weisen koordinative Bindungen auf („höherer Ordnung“, nicht ionisch!) und werden in Formeln durch eckige Klammern dargestellt (Zentralatom vorne, Liganden in Klammern). Beispiele:Cu2+ + 2 Cl- CuCl2 (eine „normale“ ionische Bindung entsteht, ein Salz), aber:CuCl2 (gelöst) + 2 Cl-[Cu(Cl)4]2- (eine koordinative Bindung wird gebildet: Cu2+ + 4 Cl-[Cu(Cl)4]2-, neongrün ).
Ähnlich bilden Kupfer(II)-ionen auch mit Wassermolekülen (!) und mit Ammoniakmolekülen (II) farbige Komplexe:
(I) CuSO 4( fest, trocken farblos ) + 4 H 2O  [Cu(H 2 O) 4 ] 2+( hellblauer Komplex ) + SO 4 2-Kupfer(II)-sulfat (weiß) + Wasser
[Cu(H 2 O) 4 ] 2+( hellblauer Komplex ) + SO 4 2-Kupfer(II)-sulfat (weiß) + Wasser 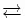 Tetraquokupfer(II)-Komplex + Sulfat-Anion (gelöst) (II) Cu 2++ 4 NH 3 [Cu(NH 3 ) 4 ] 2+( tiefblau, koordinative Bindung ).
Tetraquokupfer(II)-Komplex + Sulfat-Anion (gelöst) (II) Cu 2++ 4 NH 3 [Cu(NH 3 ) 4 ] 2+( tiefblau, koordinative Bindung ).
1 Komplexe reagieren anders als freie Ionen. Ihre Reaktionsform ist derLiganden-Austausch.
Beispiele: Cu 2++ Fe → Cu + Fe 2+( Redox ), aber: [Cu(NH 3) 4] 2++ Fe zeigen keine Reaktion!
[Cu(NH 3) 4] 2+(tiefblau, pH >7) + 4 Cl - 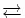 [Cu(Cl) 4] 2-(hellgrün) + 4 NH 3
[Cu(Cl) 4] 2-(hellgrün) + 4 NH 3
[Cu(H 2O) 4] 2+(hellblau, pH <7) + 4 Cl - 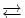 [Cu(Cl) 4] 2-(hellgrün) + 4 H 2O
[Cu(Cl) 4] 2-(hellgrün) + 4 H 2O
[Cu(H 2O) 4] 2+(hellblau, pH <7) + 4 NH 3 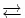 [Cu(NH 3) 4] 2+(tiefblau, pH >7) + 4 H 2O
[Cu(NH 3) 4] 2+(tiefblau, pH >7) + 4 H 2O
CuSO 4(farblos, fest, trocken) + 4 H 2O 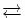 [Cu(H 2O) 4] 2+(hellblau)
[Cu(H 2O) 4] 2+(hellblau)
1 Komplexe sind oft farbig, weil die Elektronen über den ganzen Komplex verteilt werden und deshalb mit Licht(teilchen) in Wechselwirkung treten können. Ihre Bildung eignet sich gut für Nachweisreaktionen.
Beispiele: [Cu(NH 3) 4] 2+(tiefblau) [Cu(H 2O) 4] 2+(hellblau) [Cu(Cl) 4] 2-(hellgrün) [Bi(I) 4] -(orange) [Fe(NO)(H 2O) 5] 2+(braun) [Fe(CN) 6] 4-(rot) [Fe(H 2O) 6] 2+(schwach grünlich) [Fe(SCN) 3] (blutrot, verdünnt orangegelb) H[Co(SCN) 4] (in Amylalkohol blau) Nickel-DMG (himbeerrot, vgl. Merksatz 104).
Hinweis: Komplexe sind in der Chemie oft bedeutsame Farb- und Naturstoffe oder auch Katalysatoren.Chlorophyll (Blattgrün, ein Magnesiumkomplex) und Hämoglobin (der rote Blutfarbstoff, ein Eisen-Komplex) sind z.B. wichtige Komplexe (Biochemie). Ausnahmsweise farblose Komplexe sind: [Fe(F) 6] 3-, [Ag(NH 3) 2] +, [Ag(S 2O 3) 2] 3-, [Zn(OH) 4] 2-, [Al(OH) 4] -u.a.
1 Die Namen von Komplexen werden bei Kationen aus den Zahlsilben, den Liganden- und den Metallnamen mit Ladungszahl gebildet. Bei den anionischen Komplexen geht man bei Metallen von lateinischen Namen aus und setzt die Endung –at (wie bei Anionen).Beispiele:[Cu(NH3)4]2+ Tetramminkupfer(II)-Komplex[Cu(Cl)4]2- Tetrachlorokuprat(II)-Komplex[Ag(NH3)2]+ Diamminsilber(I)-Komplex [Ag(S2O3)2]3- Dithiosulfatoargentat(I)-Komplex[Fe(CN)6]4- Hexacyanoferrat(II)-Komplex[Fe(CN)6]3- Hexacyanoferrat(III)-Komplex[Bi(I)4]-. Tetraiodobismutat(III)-Komplex [Fe(NO)(H2O)5]2+ Pentaquonitrosyleisen(II)-K.
2 Die geometrische Struktur der Komplexe richtet sich oft nach dem Zentralatom (der Anordnung / Koordination von Liganden um das Zentralatom): Bei zwei „einzähnigen“ Liganden (Koordinationszahl = 2) ist der Komplex linear, bei Koordinationszahl 4 tetraedrisch oder quadratisch-planar, bei Koordinationszahl 6 ist er oktaedrisch.Beispiele: [Ag(NH3)2]+linear, [Fe(F)6]4-oktaedrisch,
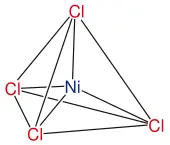
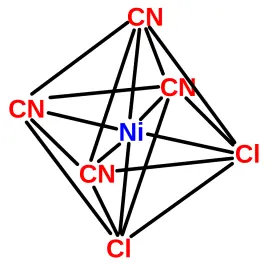 Ni(Cl) 4 2- tetraedrisch, Ni(CN) 6 4- oktaedrisch
Ni(Cl) 4 2- tetraedrisch, Ni(CN) 6 4- oktaedrisch
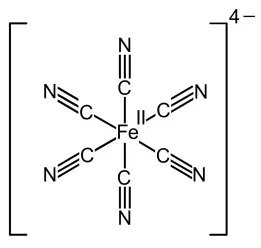
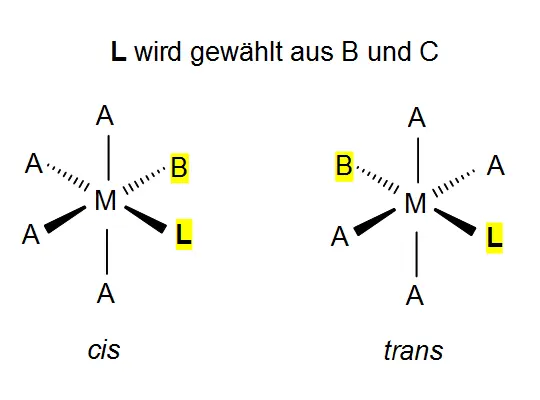
[Fe(CN) 6] 4- ebenfalls oktaedrisch cis/trans-Formen
Bildquellen: Tetrachloroniccolat-Komplex: Von Leyo - Eigenes Werk, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=8467529, Hexacyanoniccolat-Komplex: Philnate, über: https://commons.wikimedia.org/wiki/File:CisoktaKomplex.svg(ebenf. gemeinfrei)
Grundwissen zur Physikalischen Chemie
1 Die Massem einer Stoffportion gibt an, wie groß ihr Gewicht ist (im Vergleich zu 1 kg bzw. dem Gewicht von einem Liter Wasser bei +4°C)
2 Die Stoffmengen einer Stoffportion gibt an, wie groß sie hinsichtlich der chemischen Wertigkeit/Bindungs- und Reaktionsfähigkeit ist (im Vergleich zu 1 MolKohlenstoff, das sind 12 Gramm 12C-Kohlenstoff: Eine Stoffportion von 1 mol enthält 6,023 1023 Teilchen)
3 Das VolumenV einer Stoffportion gibt an, welchen Rauminhalt eine Stoffportion einnimmt (im Vergleich zu einem Liter = 1 dm3)
4 Die Dichte einer Stoffportion ergibt sich, indem man ihre Masse m durch ihr Volumen V dividiert: = m / V.
5 Die Grundgesetze der Chemie beschreiben, wie sich Massen oder Stoffmengen von Stoffen verhalten, die miteinander reagieren. (Vgl. Kapitel 3 oben)
Читать дальше
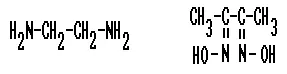


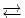 [Cu(H 2 O) 4 ] 2+( hellblauer Komplex ) + SO 4 2-Kupfer(II)-sulfat (weiß) + Wasser
[Cu(H 2 O) 4 ] 2+( hellblauer Komplex ) + SO 4 2-Kupfer(II)-sulfat (weiß) + Wasser 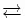 Tetraquokupfer(II)-Komplex + Sulfat-Anion (gelöst) (II) Cu 2++ 4 NH 3 [Cu(NH 3 ) 4 ] 2+( tiefblau, koordinative Bindung ).
Tetraquokupfer(II)-Komplex + Sulfat-Anion (gelöst) (II) Cu 2++ 4 NH 3 [Cu(NH 3 ) 4 ] 2+( tiefblau, koordinative Bindung ).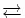 [Cu(Cl) 4] 2-(hellgrün) + 4 NH 3
[Cu(Cl) 4] 2-(hellgrün) + 4 NH 3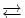 [Cu(Cl) 4] 2-(hellgrün) + 4 H 2O
[Cu(Cl) 4] 2-(hellgrün) + 4 H 2O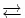 [Cu(NH 3) 4] 2+(tiefblau, pH >7) + 4 H 2O
[Cu(NH 3) 4] 2+(tiefblau, pH >7) + 4 H 2O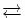 [Cu(H 2O) 4] 2+(hellblau)
[Cu(H 2O) 4] 2+(hellblau)
 Ni(Cl) 4 2- tetraedrisch, Ni(CN) 6 4- oktaedrisch
Ni(Cl) 4 2- tetraedrisch, Ni(CN) 6 4- oktaedrisch












