Por último, se produce el reclutamiento de las células periendoteliales (pericitos y células de músculo liso) que estabilizan los vasos recién formados. Este proceso se realiza por la unión de la Ang1 al receptor Tie 2, lo que aumenta su contacto con la matriz. Otros receptores celulares que intervienen son los de integrina, en especial el αvB3, esencial para la formación y el mantenimiento de los nuevos vasos. 6
Reepitelización (7º a 9º días). Los queratinocitos migran desde los bordes de la herida o desde los anexos remanentes para restablecer la barrera cutánea. La migración se produce gracias a un cambio en su fenotipo, que consiste en:
•Pérdida del aparato de adhesión (retracción de los tonofilamentos y disolución de los desmosomas).
•Adquisición de aparato motor (desarrollo de filamentos de actina y la proyección de lamelopodios hacia la herida) y la expresión de queratina K6 y K16, marcadores del estado activo. Este proceso lleva a la pérdida de unión entre las células epidérmicas entre sí, a la membrana basal y a la dermis subyacente.
El ciclo de activación del queratinocito comienza con la IL-1, que lo transforma en célula hiperproliferativa y migratoria. Al llegar a la herida se producirá la migración sobre un sustrato de matriz provisoria rica en fibronectina, mediada por receptores de superficie integrínicos (α 5 - β1) y la liberación de TGF β. Luego, la migración será sobre la matriz definitiva rica en colágeno, mediada por receptores de superficie colagénicos (α 2 - β1) y la liberación de TGF α/EGF. En la membrana basal desaparecen la laminilla y el colágeno de tipo IV. 6
Cabe destacar que, en la piel sana, los queratinocitos no están en contacto con los colágenos de la membrana basal (IV y VII) ni de la dermis (I, III y V), que son activadores de la migración y sí lo están con la laminilla de la lámina lúcida, la cual inhibe la migración de los mismos. La proliferación ocurrirá en forma superpuesta a la migración, mientras las células epiteliales continúan su viaje a través de la herida, las células proximales a estas proliferan activamente debido a la liberación de mediadores solubles (EGF/TGF α, PDGF/FGF, etc.) y al «efecto borde» (ausencia de células vecinas en aposición que dispararía el estímulo proliferativo en los márgenes de la herida). 9
Para que el queratinocito sepa cuando finalizar su proceso de migración y proliferación existen varias señales: el INF γ producido por las células inflamatorias lo estimula a expresar queratina K17, que lo convierte en contráctil y facilita la reorganización de la matriz de la membrana basal provisoria y el TGF β estimula la producción de queratinas K5 y K14, que lo convierten en una célula basal para iniciar nuevamente la diferenciación.
La reparación de la membrana basal con el nuevo depósito de laminilla es una señal para el queratinocito que indica que la herida está reparada y no hay necesidad de migrar. 9
Fase inflamatoria ( figura 1-1).
Contracción de la herida. Como se describió, los fibroblastos sufren una serie de cambios fenotípicos. Primero adoptan un fenotipo migratorio, luego uno profibrótico (mientras producen colágeno I, III y VI) y, posteriormente, alrededor del noveno día del proceso de cicatrización, adoptan el de miofibroblasto: es rico en microfilamentos de actina en el lado citoplasmático de la membrana y establece uniones célula-célula (adherentes) y con la matriz extracelular a través de receptores integrínicos.
El colágeno neoformado se une a través de enlaces covalentes cruzados con haces del borde de la herida y con haces de la dermis adyacente. Estas uniones crean una red a través de la herida y así la tracción que realizan los fibroblastos a la matriz pericelular se puede transmitir y dar como resultado una contracción coordinada. 6En una herida de espesor completo hay reducción del tamaño en un 40% respecto al tamaño original.
El TGF β estimula la contracción de los fibroblastos; también intervienen la angiotensina, las prostaglandinas, la bradiquinina y la endotelina.
En el último día de la cicatrización, los fibroblastos inician su proceso de apoptosis, estableciéndose una transición de una cicatriz rica en fibroblastos y tejido de granulación, a una cicatriz celular.
Fase de remodelación tisular
Es la última etapa; comienza al mismo tiempo que la fibroplasia y continúa por meses. La célula principal es el fibroblasto, que produce fibronectina, ácido hialurónico, proteogliucanos y colágeno durante la fase de reparación y que sirven como base para la migración celular y soporte tisular.
Con el tiempo, la fibronectina y el ácido hialurónico desaparecen por acción de las enzimas proteasas y hialuronidasas, respectivamente.
Al cabo de un año o más, el colágeno tipo III que se depositó durante la reparación es reemplazado por el de tipo I, con un fenotipo más estable y similar al que tenía la dermis originalmente.
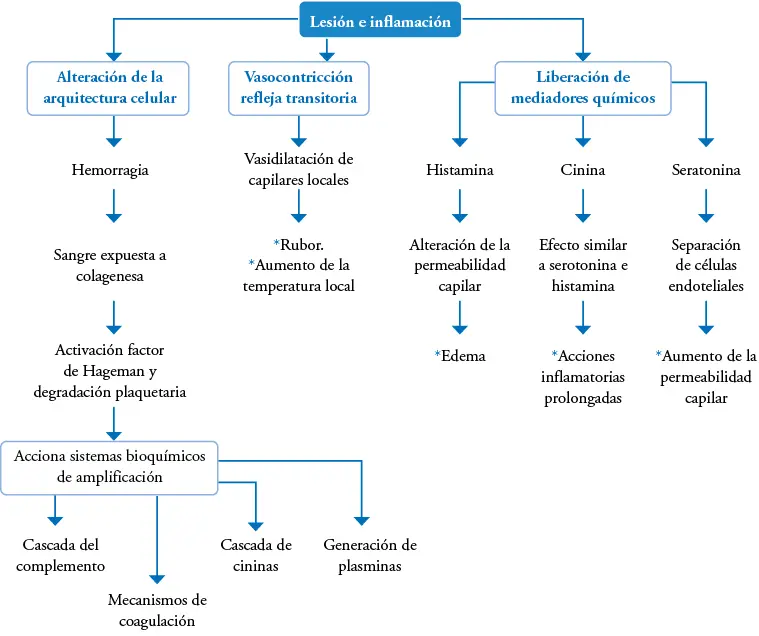
Figura 1-1. Fase de latencia o inflamatoria.
Tomado de: EL cuidado del niño quemado. Universidad Pontificia de Chile. Escuela de enfermería. http://www7.uc.cl/sw_educ/ninoquemado/html/mod4/lcicatriza.html
La degradación del primer colágeno se debe a la acción de las metaloproteinasas de la matriz (colagenasas, gelatinasas y estromalisinasas), cuya actividad depende de los iones de zinc y que son estimuladas por los factores de crecimiento y por los componentes de la matriz extracelular. Al final del proceso, la cicatriz adquiere una resistencia máxima del 70% comparada con el tejido sano; esto se debe a que los colágenos fibrilares forman haces fibrosos que aumentan mucho la fuerza tensil del nuevo tejido.
La actividad celular disminuye y el tejido conjuntivo cicatricial se torna rico en colágeno, pobre en células y vasos, sin folículos pilosos y sin glándulas sudoríparas ni sebáceas. La dermis recupera la composición previa a la lesión y la reparación de la herida se considera finalizada.
Proceso de cicatrización en las heridas crónicas
En las HC, las 4 fases del proceso de cicatrización tisular se hallan «alteradas», ya que se detienen en la fase inflamatoria debido a un disbalance entre los factores de crecimiento y las proteasas (figura 1-2).
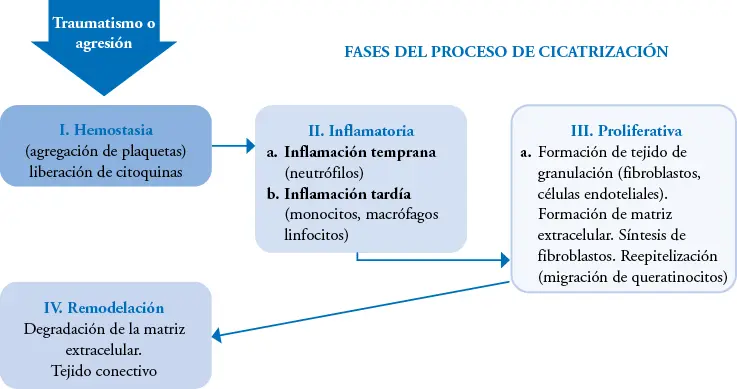
Figura 1-2. Proceso de cicatrización por fases.
Cortesía del autor.
Este desequilibrio se debe a la presencia exagerada de citocinas proinflamatorias, disminución de los factores de crecimiento, alteración en el depósito de colágeno y de la matriz, alteración de la proliferación celular y de la síntesis proteica y aumento de la apoptosis.
En las HC, los factores de crecimiento son captados por moléculas como la albúmina, el fibrinógeno y la α-2- macroglobulina, que se extravasan hacia la dermis. La molécula de α-2- macroglobulina es captadora del PDGF entre otros.
En las HC, el exudado contiene una excesiva cantidad de metaloproteinasas que comprometen a la matriz extracelular y, probablemente, contengan citocinas y factores de crecimiento. Hay que considerar que en los tejidos que rodean a las HC, los fibroblastos pueden ser senescentes e insensibles a ciertas citocinas y factores de crecimiento; por ejemplo, en las úlceras venosas no responden a la acción del TGF-β1 y del PDGF. 10
Читать дальше














