Bewährt hat sich die Ausbildung an Schlachtabfällen. Ein Modell basierend auf Larynx und Schwarte vom Schwein vermittelt die Haptik von biologischem Gewebe, wenn gleich ohne Blutung, und lässt das Üben aller notwendigen Schritte zur chirurgischen Atemwegssicherung zu.
Um die Situation für die Auszubildenden realitätsnäher zu gestalten, wurde im Rahmen einer Studie eine Schaufensterpuppe entsprechend als Modellträger umgebaut ( 
Abb. A3.4 Abb. A3.4: Hybridmodell mit variabler Halsanatomie
) und durch die Verwendung von Schweineschwarte mit entsprechend mehr Unterhautfettgewebe lässt sich eine schwierige Halsanatomie simulieren. Mit diesem Modell konnte bestätigt werden, dass bei einer adipösen Halsanatomie Zeitbedarf und Komplikationsrate erhöht sind und zukünftige Trainingsmodelle solche Schwierigkeiten abbilden sollten.
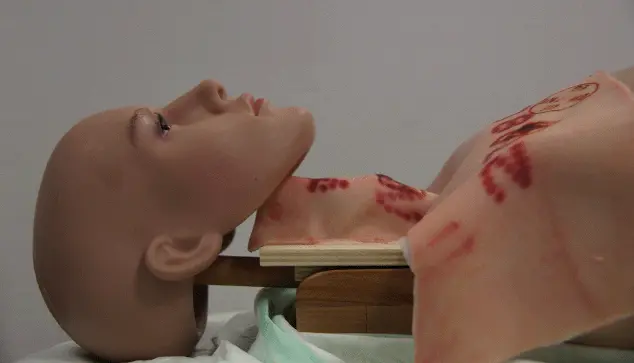
Abb. A3.4: Hybridmodell mit variabler Halsanatomie
Die chirurgische Atemwegssicherung ist eine sehr selten erforderliche, in diesen wenigen Fällen aber absolut lebensrettende Notfall-Maßnahme (»ultima ratio«) und muss deshalb von jedem, der mit Atemwegsmanagement betraut ist, beherrscht werden. Gerade bei veränderter Anatomie (z. B. infolge von Verletzungen) hat sich die chirurgisch anatomische Präpariertechnik vorteilhaft gegenüber den Punktionstechniken erwiesen. Allerdings sollten Anwender diejenige Technik bevorzugen, mit der sie routiniert umgehen können. Das Material für die trainierte Technik muss jederzeit verfügbar sein. Sowohl die Ausbildung als auch ein regelmäßiges Training sollte an Modellen erfolgen, mit denen eine schwierige Anatomie simuliert werden kann.
AWMF (2019) S1 Leitlinie »Prähospitales Atemwegsmanagement« ( https://www.awmf.org/leitlinien/detail/ll/001-040.html).
Frerk C, Mitchell VS, McNarry AF et al. (2015) Difficult Airway Society 2015 guidelines for management of unanticipated difficult intubation in adults. Br J Anaesth 115: 827–848.
Helm M, Hossfeld B, Jost C et al. (2011) Chirurgische Atemwegssicherung in der präklinischen Notfallmedizin. Notfall Rettungsmed 14: 29–36.
Helm M, Hossfeld B, Jost C et al. (2013) Emergency cricothyroidotomy performed by inexperienced clinicians – surgical technique versus indicator-guided puncture technique. Emerg Med J 30: 646–649.
Hossfeld B, Mahler O, Mayer B, Kulla M, Helm M (2019) Necessity to depict difficult neck anatomy for training of cricothyroidotomy: A pilot study evaluating two surgical devices on a new hybrid training model. European Journal of Anaesthesiology 36: 516–523. ( http://doi.org/10.1097/EJA.0000000000000993).
Nakstad AR, Bredmose PP, Sandberg M (2013) Comparison of a percutaneous device and the bougie-assisted surgical technique for emergency cricothyrotomy: an experimental study on a porcine model performed by air ambulance anaesthesiologists. Scand J Trauma Resusc Emerg Med 21: 59.
B Breathing
B.1 Der Spannungspneumothorax in der Notfallmedizin
Stephan D. Kurz
B1.1 Einleitung
Ein Spannungspneumothorax entwickelt sich in der Regel aus einem Pneumothorax. Es gelangt Luft in den Pleuraspalt und es bildet sich im weiteren Verlauf ein Ventilmechanismus (Ein-Wege-Ventil). Es sammelt sich Luft im Pleuraspalt, komprimiert die Lunge, verschiebt das Mediastinum zur kontralateralen Seite und erhöht schließlich progredient den intrathorakalen Druck. Der venöse Rückstrom zum Herzen wird vermindert und es kommt damit zu einer Reduzierung des Herz-Zeit Volumens.
Die Entlastung des Pleuraspalts durch Anlage einer Thoraxdrainage ist eine sofort durchzuführende Maßnahme, um eine Instabilität oder den Tod des Patienten abzuwenden. Die Anlage einer Thoraxdrainage ist in der Notfallmedizin ein eher selten angewandtes Verfahren, gehört jedoch im Rahmen der Versorgung von Traumapatienten mit zu den entscheidenden Maßnahmen, die das Überleben des Patienten sichern (Kleber et al. 2013; Gries et al. 2006; Di Bartolomeo et al. 2001).
Dieser Buchbeitrag gibt einen Überblick über die Ätiologie, die Diagnostik, Technik und mögliche Komplikationen in der Durchführung einer notfallmäßigen Entlastung eines Spannungspneumothorax.
Der Pleuraspalt im Thorax besteht aus einer zweiblättrigen Mesothelschicht und zählt zu den serösen Häuten. Sie unterteilt sich in die Pleura visceralis (Lungenfell) als inneres Blatt der Pleura, welches die beiden Lungenflügel umhüllt und der Pleura parietalis (Rippenfell) als das äußere Blatt der Pleura. Die daraus entstehende Cavitas pleuralis (Pleuraspalt) enthält wenige Milliliter seröser Flüssigkeit und wird auch als Cavum pleurae bezeichnet. Gelangen Blut, Luft oder andere Körperflüssigkeiten in den Pleuraspalt, kann es durch deren Ansammlung zu einer Kompression der thorakalen Organe kommen.
Das klinische Bild ist abhängig von der Ausgangssituation des Patienten. Man kann grundsätzlich zwischen einem beatmeten und einem Patienten mit Spontanatmung unterscheiden. Bei einem Patienten mit Spontanatmung spricht man von einem 1-Wege-Klappenventil, das sich während des Einatmens öffnet und während des Ausatmens schließt, was zu einem progressiven Pneumothorax führt.
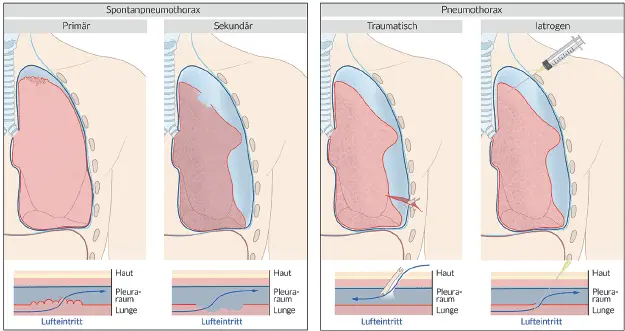
Abb. B1.1: Unterscheidung der verschiedenen Ursachen des Pneumothorax (Quelle: AMBOSS GmbH, »Ätiologie des Pneumothorax«, Abbildung 5096, Berlin 2021)
Die typischen klinischen Zeichen sind Dyspnoe, Tachypnoe, obere Einflussstauung (gestaute Halsvenen), eine Erhöhung des Atemzugvolumens und eine zunehmende kontralaterale Brustkorbbewegung.
Bei den Patienten unter assistierter oder kontrollierter Beatmung kommt es durch den erhöhten inspiratorischen und intrapleuralen Druck zu einer sofortigen und progredienten Abnahme des venösen Rückstroms zum Herzen, die möglicherweise häufiger zu einer Hypotonie und einem dadurch resultierenden Herz-Kreislaufstillstand führen kann (Roberts et al. 2014; Barton 1999; Martin et al. 2012; Nelson et al. 2013).
Die typischen klinischen Zeichen eines Spannungspneumothorax bei beatmeten Patienten sind ansteigende Beatmungsdrücke, sinkende Tidalvolumina, progrediente obere Einflussstauung (bläulich-livide Verfärbung von Kopf und Hals), Hypotonie und Kreislaufstillstand (elektromechanische Entkopplung).
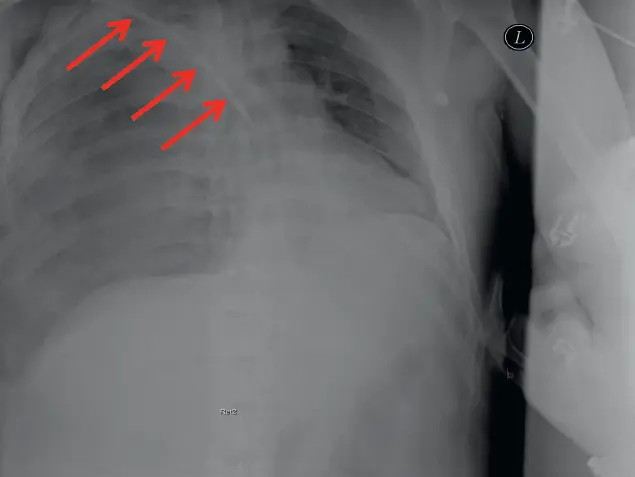
Abb. B1.2: »Spannungshämatopneumothorax rechts. Z. n. Anlage eines Sheldon-Katheters (rote Pfeile). (© C. Kleber)
B1.3 Präklinische Diagnostik
Die wichtigste diagnostische Maßnahme ist die körperliche Untersuchung, die Auskultation (abgeschwächtes Atemgeräusch, hypersonorer Klopfschall, pulssynchrones Klicken auf der betroffenen Seite), die Inspektion (Verletzungszeichen, Symmetrie des Thorax und der Atemexkursion, paradoxe Atmung, Dyspnoe, Halsvenenfüllung) und die Palpation (Hautemphysem, Schmerzpunkte, Krepitationen, Instabilitäten des knöchernen Thorax) (Miller 2008; Di Bartolomeo et al. 2001). Je nach Einsatzsituation sind Umgebungsfaktoren wie Lärm bei der Auswahl und Deutung der Basisuntersuchung und Diagnostik zu beachten. Zu den Leitlinienempfehlungen gehören mindestens die klinische Untersuchung des Thorax und der Atemfunktion, die Bestimmung der Atemfrequenz und die Auskultation der Lunge. Diese Maßnahmen sollten im weiteren Verlauf ständig erneut durchgeführt werden. Eine elegante Methode zur präklinischen Diagnostik bietet die Ultraschallsonografie. Einen standardisierten Untersuchungsablauf bietet das sogenannte FAST-Protokoll (FAST = focussed assessment with sonography for trauma). Hierbei steht die Untersuchung nach freier Flüssigkeit im Vordergrund. Eine Erweiterung der Ultraschalldiagnostik auf die Lunge kommt beim E-FAST-Protokoll (= extended FAST) zur Anwendung.
Читать дальше
















