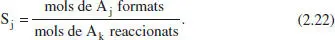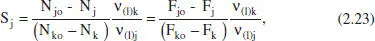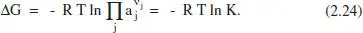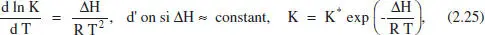1 ...6 7 8 10 11 12 ...26 2.2.3.3 Rendiment
Hi ha moltes definicions per a aquest concepte, però una de les seues formes més simples seria:

Aquesta definició (rendiment global) s’ha de matisar afegint la relació estequiomètrica per a obtenir resultats raonables. Així,

on (1) es refereix a l’esquema de reacció que condueix del component clau (A k.) al producte d’interès (A j). El rendiment puntual o instantani representa el quocient entre les velocitats de producció de A ji de consum de A k
2.2.3.4 Selectivitat
També en aquest cas es tenen moltes definicions per a aquest concepte, però una de les formes més simples seria
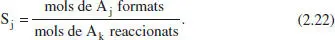
Aquesta definició també s’ha de matisar afegint la relació estequiomètrica per a obtenir resultats raonables. Així,
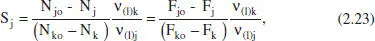
on (1) es refereix a l’esquema de reacció que condueix del component clau (A k) al producte d’interès (A j). Alguns autors anomenen selectivitat al que ací s’ha denominat rendiment puntual; per això, en cada cas caldrà establir la definició que s’està utilitzant. En el capítol 6 es tractaran aquests conceptes amb més amplitud.
2.3 Equilibri químic
En altres assignatures s’ha estudiat el càlcul de la composició en l’equilibri i la influència de diferents variables sobre aquesta composició. Ací simplement es vol recordar que l’equilibri químic marca un límit, és a dir, constitueix una restricció per a les variables que representen el sistema. Així, per exemple, la variable grau de conversió, tal com s’ha definit en l’apartat anterior, està acotada entre 0 i 1, però ara ho estarà entre 0 i X e(grau de conversió en l’equilibri). D’aquesta manera, la zona permesa per a aquesta variable (i les composicions associades a ella) queda restringida a una regió menor que la que permeten els canvis estequiomètrics.
La conditió d’equilibri porta a un mínim de la funció de Gibbs, la qual cosa permet introduir el concepte de constant termodinàmica d’equilibri , per a cada una de les reactions:
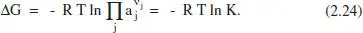
2.3.1 Influència de la temperatura
El punt de partida per a analitzar la influència de la temperatura sobre la composició en l’equilibri és l’equació de Van’t Hoff:
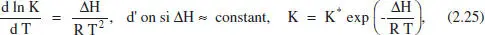
d’on es pot deduir que si la reacció és exotèrmica (Δ H <0), en augmentar la temperatura la constant d’equilibri A"disminueix, i amb ella també ho fa X e. Al contrari, si la reacció és endotèrmica (Δ H >0), en augmentar la temperatura augmenta K ,i amb ella X e. Situations que estan d’acord amb el principi de Le Chatelier-Braun. La forma d’aquestes variations poden observar-se en les figures 2.9 i 2.10.
2.3.2 Altres influències
En diferents textos (Modell i Reid, 1974; Aris, 1969) es pot estudiar la influència de variables com ara pressió, presència d’inerts, composició initial, etc., i no s’analitzaran ací amb detail. No obstant això, es recordarà que aquestes variables no influeixen sobre K , però evidentment poden afectar la composició en l’equilibri.
2.4 Tipus de reactor
Tal com es va comentar en el capítol l hi ha una gran varietat de tipus, grandàries, formes, colors, etc. de reactors, per la qual cosa es procedeix a una classificació d’aquests:
2.4.1 Classificació dels reactors químics
2.4.1.1 Per la forma d’operar
Segons el tipus d’operació, els reactors poden ser discontinus, continus o semicontinus.
El reactor discontinutambé es coneix com a intermitent , o per càrregues ( batch ), noms que descriuen el seu funcionament. El comportament d’aquest reactor és sempre no estacionari, funciona per cicles, és flexible i presenta un cost inicial baix. El producte pot presentar falta d’homogeneïtat entre les diferents càrregues (cicles).
El segon tipus és el continu. El comportament habitual d’aquest reactor és estacionari, resulta fàcil d’automatitzar i controlar, presenta menor cost d’operació, el producte sol ser molt homogeni.
El comportament semicontinués intermedi (híbrid) entre els anteriors, per la qual cosa normalment serà no estacionari. La seua flexibilitat facilita el control de la temperatura. Presenta moltes disposicions. Per exemple, si tenim dos reactius, es pot introduir inicialment un dels reactius (discontinu) i després introduir l’altre de manera contínua. Una altra situació semicontínua correspon al cas en què un dels productes de la reacció és volàtil, el funcionament és bàsicament discontinu, excepte pel fet que aquell producte s’elimina contínuament. Aquest procediment pot facilitar la superació de les limitacions relacionades amb l’equilibri que apareixen en altres reactors. El comportament semicontinu proporciona una sèrie de graus de llibertat extra en les mans del dissenyador. En la figura 2.2 s’esquematitzen els funcionaments que s’acaben de comentar.
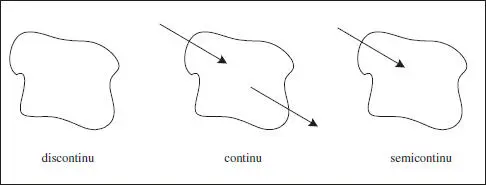
Figura 2.2. Esquemes dels reactors classificats per la forma d’operar.
2.4.1.2 Per la forma de circular o de posar en contacte la mescla reaccionant
D’acord amb la forma de circular la mescla reactiva, els reactors poden ser de tanc agitat o tubulars.
El nom de reactor tubular, a més de la referència a l’aspecte del reactor, indica que la mescla avança en una direcció i la composició canviarà en aquesta direcció, a causa de la reacció química (c j= f(z)).
En el funcionament conegut com de tanc agitat, l’agitació provoca una homogeneïtzació del sistema i no es troben variacions ni en la composició ni en la temperatura [c j≠ f(x, y, z), T ≠ f(x, y, z)]. En la figura 2.3 s’esquematitzen els funcionaments que s’acaben de comentar:
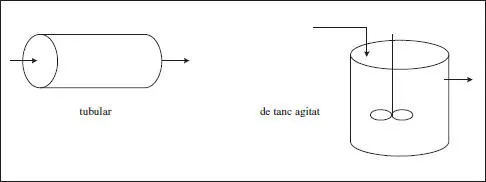
Figura 2.3. Esquemes dels reactors classificats per la forma de circular.
2.4.1.3 Per la forma d’intercanviar calor
D’acord amb aquest punt de vista un reactor pot ser:
Adiabàtic, quan no hi ha intercanvi de calor amb l’exterior (q = 0).
No adiabàtic, en cas contrari (q ≠ 0). Al seu torn, poden contemplar-se el comportament isoterm, en què l’intercanvi de calor és l’adequat perquè no hi haja canvi en la temperatura, i el no isoterm en cas contrari.
Читать дальше