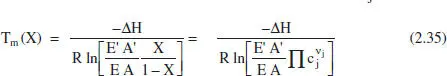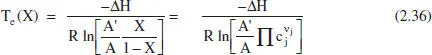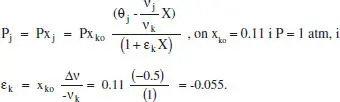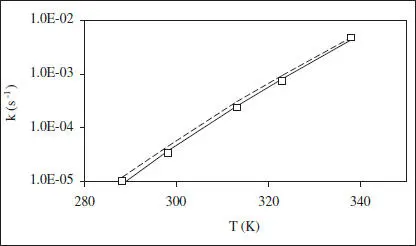
Figura E2.4. Ajust lineal (línia continua) i no lineal (línia discontinua) del model d’Arrhenius.
A continuació es comentaran els mapes de corbes de r constant per a les diferents reaccions en un diagrama grau de conversió-temperatura. D’aquesta manera queda patent no sols la zona permesa, sinó la influència d’ambdues variables: composició (a través de la conversió) i temperatura. Sobre aquest mapa es desenvoluparà la reacció química, el camí triat tindrà una influència determinant en el comportament del reactor.
2.5.3 Corbes de velocitat de reacció constant en el diagrama X-T
2.5.3.1 Reaccions irreversibles
En la figura 2.7 s’han representat les corbes de r constant, en el diagrama X-T , per a una reacció irreversible. S’hi pot veure que r decreix en augmentar X a T constant (disminueix la concentració de reactiu), i que r creix en augmentar T a X constant (augmenta k ).
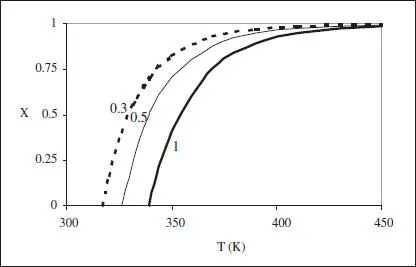
Figura 2.7. Corbes de r constant per a una reacció irreversible. El paràmetre correspon al valor de r .
2.5.3.2 Reaccions reversibles
• Endotèrmica
Com que Δ H >0, de l’equació (2.33) es dedueix que E > E’ ( k i k’ augmenten amb T, però k ho fa d’una manera més acusada). En la figura 2.8 s’han representat les corbes de r constant, en el diagrama X-T , per a una reacció endotèrmica reversible. S’hi es pot veure que r decreix en augmentar X a T constant (disminueix la concentració de reactius i augmenta la de productes), i que r creix en augmentar T a X constant (augmenten k i k’ , però k creix més ràpidament). Aquesta figura és com la 2.7, excepte que apareix l’efecte de la reversibilitat (la corba de r = 0, que actua com una envoltant).
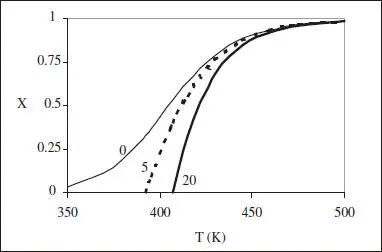
Figura 2.8. Corbes de r constant per a una reacció reversible endotèrmica. El paràmetre correspon al valor de r .
• Exotèrmica
Com que Δ H < 0, de l’equació (2.33) es dedueix que E < E’ ( k i k’ augmenten amb T , però k’ ho fa més ràpidament). En la figura 2.9 s’han representat les corbes de r constant, en el diagrama X-T , per a una reacció exotèrmica reversible. S’hi es pot veure que r decreix en augmentar X a T constant (disminueix la concentració de reactius i augmenta la de productes, en aquest aspecte els tres casos estudiats fins ací no difereixen). La diferència apareix en la influència de la temperatura, en aquesta figura es pot veure que en augmentar T a X constant r creix primerament, assoleix un màxim i decreix a continuació, aproximant-se a zero en acostar-se a la corba d’equilibri. El lloc geomètric dels màxims de r per a cada valor de X sol anomenar-se Γ m. La corba d’equilibri és Γ e.
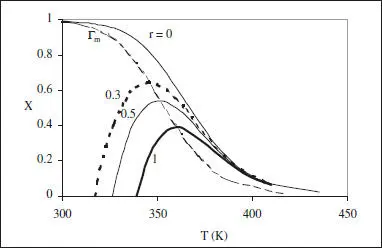
Figura 2.9. Corbes de r constant per a una reacció reversible exotèrmica. El paràmetre correspon al valor de r .
És interessant conèixer la posició de Γ mja que lògicament s’estarà interessat a treballar a elevades velocitats de reacció. Del model cinètic és fàcil deduir les equacions per a la determinació de les temperatures de màxima velocitat de reacció i d’equilibri. En les equacions on apareix el grau de conversió s’ha considerat que en la situació de referènda no hi ha producte.
Per a una reacció del tipus A 1, ↔ A 2Per a una reacció qualsevol
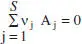
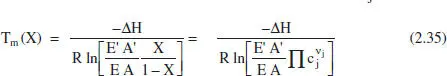
Per a les mateixes reaccions:
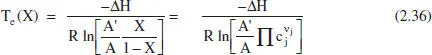
Com que E < E’, es dedueix que Te > Tm , com és logic.
2.5.3.3 Reaccions autocatalítiques
Són les que no compleixen alguna de les relacions (2.30). Per exemple, si la reacció A 1→A 2segueix una cinètica del tipus r = k c 1c 2és autocatalítica pel que fa a A 2, ja que el producte del seu coeficient estequiomètric (+1) per l’ordre de la reacció directa (+1) dóna positiu, cosa que contradiu Fequació (2.30). El component 1 segueix aquella equació, ja que el citat producte dóna negatiu. El component que dóna el caràcter autocatalític és el segon. No és freqüent que 1'augment de la concentració de producte tinga un efecte positiu sobre la velocitat de reacció. En 1'exemple 2.3 ha aparegut un cas amb aquest comportament.
En la figura 2.10 s’han representat les corbes de r constant per a una reacció com la que s’està comentant. S’hi pot veure que r creix en augmentar T a X constant (com correspon a una reacció irreversible). La diferència apareix en la influència de la conversió, en la figura es pot veure que en augmentar X a T constant r creix en primer Hoc, assoleix un màxim i decreix a continuació, aproximant-se a zero en acostar-se a X = 1.
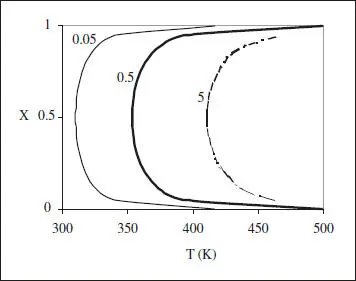
Figura 2.10. Corbes de r constant per la reacció autocatalítica A 1→ A 2. El paràmetre correspon al valor de r.
Exemple 2.5
El reactor continu en què es portarà a terme la reacció analitzada en l’exeniple 2.3 operarà de forma isoterma, a la pressió atmosfèrica, i l’aliment s’introdueix amb un cabal molar de 45 kmol/h i amb un 11 % de SO 2,10 % de O 2i 79 % de N 2(% molars). S’ha triat el SO 2com a component clau. És l’elecció més adequada? Relacioneu la pressió parcial de cada espècie amb la conversió i avalueu tots els paràmetres coneguts. Calculeu aquestes pressions parcials per a:
a) L’entrada del reactor (conversió 0) i 983 K.
b) Un 71 % de conversió i una temperatura de 983 K.
c) Un 71 % de conversió i una temperatura de 683 K. Justifiqueu la variació.
Solució:
L’elecció del SO 2com a component clau és la més adient, ia que el SO 2és el reactiu limitador. Per a poder calcular r, cal expressar les pressions parcials de cada component en funció del grau de conversió:
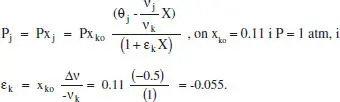
Aplicant l’equació anterior a cada espècie:
Читать дальше