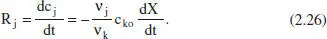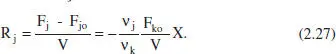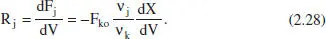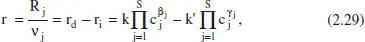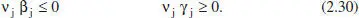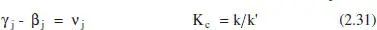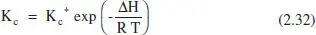1 ...7 8 9 11 12 13 ...26 2.4.1.4 Per la naturalesa de les fases presents
Atenent la naturalesa de les fases presents, els reactors poden ser:
Homogenis, quan la mescla reactiva presenta una sola fase (gas o líquida).
Heterogenis, quan estan presents i intervenen en la reacció diverses fases (gas-líquid, gas-sòlid, líquid-sòlid, líquid-líquid, sòlid-sòlid, gas-líquid-sòlid, etc.). Per exemple, la polimerització per suspensió és una reacció homogènia, encara que hi haja diverses fases, perquè la reacció succeeix únicament en una d’elles (les gotes).
2.4.2
Reactors tipus o estàndard
A la vista de les classificacions anteriors, i per a facilitar l’estudi dels distints equips, es van proposar una sèrie de reactors ideals combinant distints aspectes d’aquelles. Els reactors ideals (comportament idealitzat) són:
– Reactor Discontinu de Tanc Agitat (RDTA).
– Reactor Continu de Tanc Agitat (RCTA).
– Reactor Continu Tubular o de Flux de Pistó (RCT o RFP).
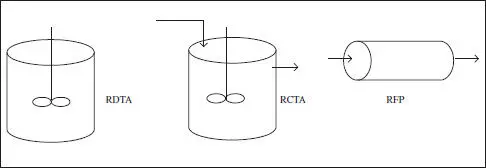
Figura 2.4. Reactors tipus, ideals o estàndard.
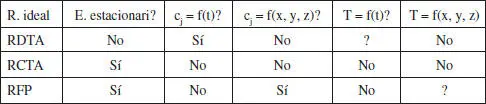
Encara que les denominacions són prou explícites, aquests reactors s’esquematitzen en la figura 2.4, i en la taula 2.2 es detallen les seues característiques.
TAULA 2.2
Característiques dels reactors ideals
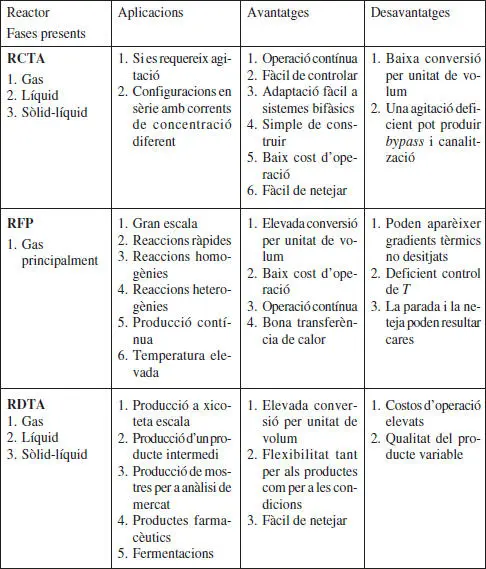
En la taula 2.3 s’assenyalen les aplicacions, els avantatges i els desavantatges d’aquests reactors.
TAULA 2.3
Aplicacions, avantatges i desavantatges dels reactors químics ideals
2.5 Cinètica química
La cinètica química estudia la velocitat de les reaccions químiques. Ací recordarem breument el concepte de velocitat de reacció ( R j) com el nombre de mols de A jque reaccionen per unitat de temps i per unitat de volum. Aquesta referència a la unitat de volum és adequada per a les reaccions homogènies, però per a les heterogènies sol canviar-se per la unitat de massa de catalitzador o de superfície interficial. Aquestes definicions de la velocitat de reacció s’utilitzaran en el capítol 10.
L’aplicació pràctica d’aquesta definició ha sigut font de conflicte durant anys, per això, per no deixar cap dubte respecte d’aquest tema, s’escriurà a continuació per als diferents reactors ideals. Simplement cal tenir en compte que el concepte velocitat de reacció apareix en el balanç de matèria del component j (es poden veure en l’apartat 2.6) en el terme de generació.
Per a un RDTA ideal de volum constant en què té lloc una reacció química, del balanç de matèria es dedueix
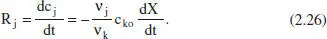
És a dir, en aquest cas, la velocitat de reacció ve donada per la velocitat de variació de la concentració d’un component amb el temps. Com que aquest reactor és el més utilitzat per a estudis cinètics, l’equació (2.26) és també la més freqüent en aquests estudis. La seua aplicació a l’anàlisi d’experiments desenvolupats amb altres reactors serà font d’error.
Per a un RCTA en estat estacionari l’equació anterior indicaria que no hi ha reacció, però en aquest cas el balanç de matèria condueix a
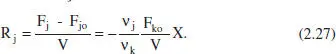
En aquest cas, la velocitat de reacció ve representada per la diferència entre els cabals molars d’eixida i entrada del component j. Cal assenyalar que l’aplicació de l’equació (2.26) a aquest reactor produiria un valor nul de la velocitat de reacció a causa del comportament estacionari del sistema.
Finalment, per a un RFP en estat estacionari es té
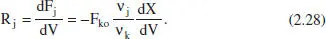
Les equacions (2.26) a (2.28) mostren que la mesura experimental de la velocitat de reacció requereix un tractament diferenciat d’acord amb el reactor que s’estiga utilitzant.
S’entén la velocitat de reacció com una magnitud intensiva característica de la reacció. Aquesta variable depèn d’una gran quantitat de variables, encara que per simplicitat solen reduir-se a dues: concentració i temperatura, sobreentenent que les altres variables que influeixen sobre R jromanen constants en tots els casos o estan incloses en les anteriors. Així, en un sistema gasós, la pressió quedarà fixada en fixar la concentració i la temperatura. En un sistema en fase líquida, el pH, el dissolvent i la força iònica són exemples de variables que poden afectar la velocitat de reacció; s’han de mantenir al mateix nivell en els diferents sistemes perquè el model cinètic tinga validesa en tots ells.
2.5.1 Influència de la composició
La velocitat de reacció pot referir-se a la reacció en general en comptes de referir-se a un dels components; a més a més, el model cinètic general sol escriure’s tal com apareix en l’equació (2.29). Hi ha models més complexos; en tot cas, s’hauran de determinar sempre de forma experimental.
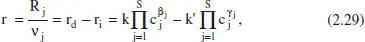
on β jés l’ordre de A jen la reacció directa i γ jés Fordre de A en la reacció inversa. Aquests ordres parcials (determinables experimentalment) han de complir una sèrie de relacions. Així, lògicament:
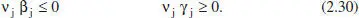
Sense entrar en details, és raonable que els reactius tinguen una influència positiva sobre la velocitat de reacció directa, i que la dels productes, en cas de tenir-la, siga negativa. El mateix raonament, però al revés, serveix per a raonar la influència de reactius i productes sobre la velocitat de reacció inversa. Les reaccions autocatalítiques no compleixen aquestes relacions i presenten, per tant, un comportament diferenciat. La consistència termodinàmica del model cinètic implica:
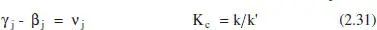
La primera part d’aquesta equació posa de manifest que l’estequiometria i els ordres de la cinètica poden no coincidir (només ho fan en les reaccions elementals).
Si estenem l’equació (2.25) a K c(no és del tot cert, però ho prenem comuna aproximació):
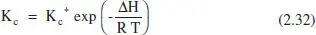
De les equacions (2.31) i (2.32), i recordant l’equació d’Arrhenius, es pot deduir:
Читать дальше