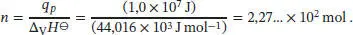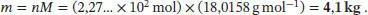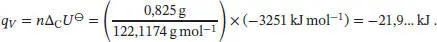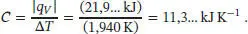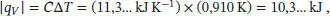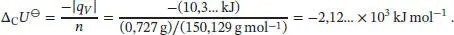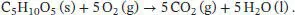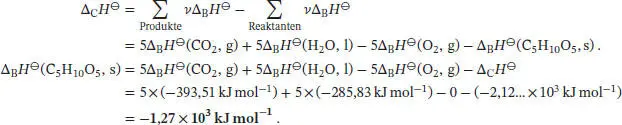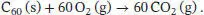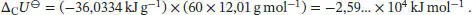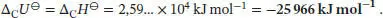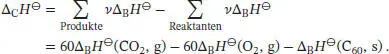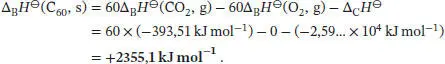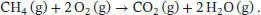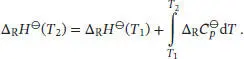
Die Differenz der molaren Wärmekapazitäten der Produkte und der Reaktanten lassen sich mithilfe von Gl. (2.32b) berechnen:
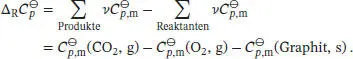
In Tab. 2.2 in Abschn. 2.2 des Lehrbuchs sind die molaren Wärmekapazitäten bei konstantem Druck in der Form 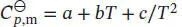 angegeben, daher schreiben wir
angegeben, daher schreiben wir 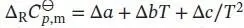 mit Δ a = a (CO 2, g) − a (O 2, g) −a(Graphit, s). In analoger Weise lassen sich entsprechende Beziehungen für Δ b und Δ c formulieren. So erhalten wir:
mit Δ a = a (CO 2, g) − a (O 2, g) −a(Graphit, s). In analoger Weise lassen sich entsprechende Beziehungen für Δ b und Δ c formulieren. So erhalten wir:
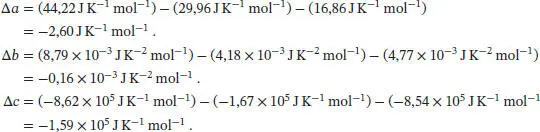
Durch Integration des Kirchhoff’schen Gesetzes erhalten wir
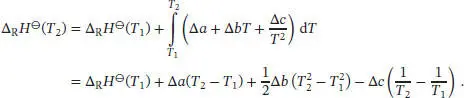
Einsetzen der Werte liefert
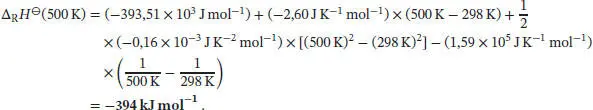
S2.3.1Bei konstantem Druck ist die Temperaturerhöhung durch Gl. (2.23) gegeben, q p= Cp Δ T . Für die Wärmekapazität verwenden wir näherungsweise den Standardwert von Wasser, 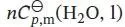 , wobei n die Stoffmenge in Mol ist. Daher ist
, wobei n die Stoffmenge in Mol ist. Daher ist

Wenn wir davon ausgehen, dass für den Wärmeverlust im Wesentlichen die Verdampfung von Wasser verantwortlich ist, H 2O (298 K, l) → H 2O (298 K, g), dann erhalten wir mit den Werten aus Tab. 2.3 des Lehrbuchs für die Stoffmenge
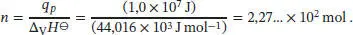
Die zugehörige Masse ist
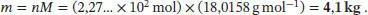
Anmerkung: Dieser Wert entspricht ungefähr 30 Gläsern Wasser pro Tag, was den normalen Konsum deutlich übersteigt. Die Diskrepanz könnte an unserer Annahme liegen, dass der Wasserverlust die dominierende Ursache für den Wärmeverlust ist.
S2.3.3
1 (a) Die Reaktionsgleichung für die Verbrennung von Cyclopropan istDie benötigten thermodynamischen Daten entnehmen wir aus Tab. 2.10 im Anhang des Lehrbuchs. Für die hier vorliegende Reaktion lautet Gl. (2.30a)Somit erhalten wir für die Standardbildungsenthalpie von Cyclopropan
2 (b) Die Standardenthalpie für die Isomerisierungsreaktion Cyclopropan → Propen ist
S2.3.5Im beschriebenen Experiment wird die Verbrennung von 0,825 g Benzoesäure ( M = 122,1174g mol −1) zur Bestimmung der Kalorimeterkonstante eingesetzt. Die im Inneren des Kalorimeters freigesetzte Wärmemenge ist
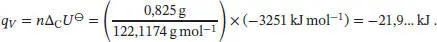
Die Kalorimeterkonstante ist daher
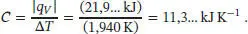
Daraus folgt für die bei der Verbrennung des Zuckers D-Ribose freigesetzte Wärme
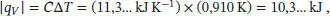
und die Innere Energie dieses Prozesses ist
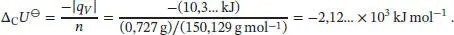
Die Reaktionsgleichung lautet
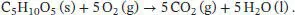
Da sich die Stoffmenge der an der Reaktion beteiligten Gase nicht ändert, gilt gemäß Gl. (2.20) ΔCU ⊖= ΔCH ⊖= −2,12… × 10 3kJ mol −1. Die Standardbildungsenthalpie Δ B H ⊖von D-Ribose berechnen wir mithilfe von Gl. (2.30a) unter Verwendung der thermochemischen Daten, die in Tab. 2.11 im Anhang des Lehrbuchs angegeben sind:
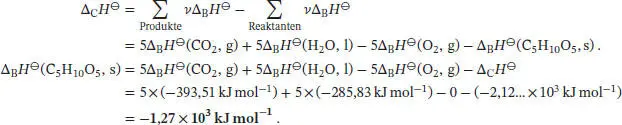
S2.3.7‡Die Reaktionsgleichung für die Verbrennung von kristallinem C 60lautet
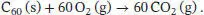
Die Innere Energie dieser Verbrennungsreaktion beträgt
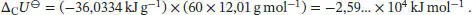
Da sich die Stoffmenge der an der Reaktion beteiligten Gase nicht ändert, gilt gemäß Gl. (2.20)
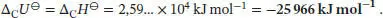
Mit Gl. (2.30a) folgt für die Standardverbrennungsenthalpie
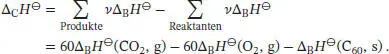
Die Standardbildungsenthalpie des kristallinen Fullerens C 60ist somit
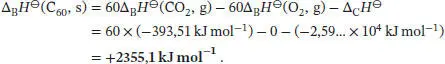
S2.3.9Die Reaktionsgleichung für die Verbrennung von Methan lautet
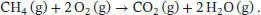
Die Standardverbrennungsenthalpie Δ C H ⊖lässt sich mithilfe von Gl. (2.30a) unter Verwendung der thermochemischen Daten berechnen, die in Tab. 2.10 und 2.11 im Anhang des Lehrbuchs angegeben sind:
Читать дальше

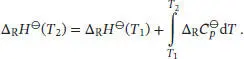
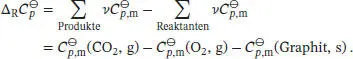
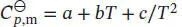 angegeben, daher schreiben wir
angegeben, daher schreiben wir 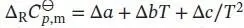 mit Δ a = a (CO 2, g) − a (O 2, g) −a(Graphit, s). In analoger Weise lassen sich entsprechende Beziehungen für Δ b und Δ c formulieren. So erhalten wir:
mit Δ a = a (CO 2, g) − a (O 2, g) −a(Graphit, s). In analoger Weise lassen sich entsprechende Beziehungen für Δ b und Δ c formulieren. So erhalten wir: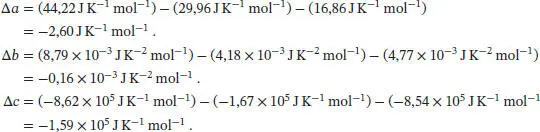
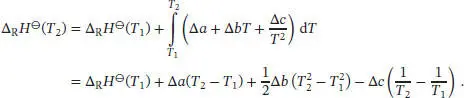
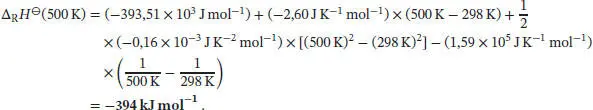
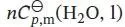 , wobei n die Stoffmenge in Mol ist. Daher ist
, wobei n die Stoffmenge in Mol ist. Daher ist