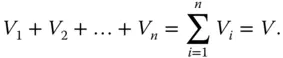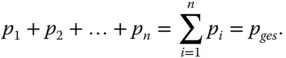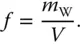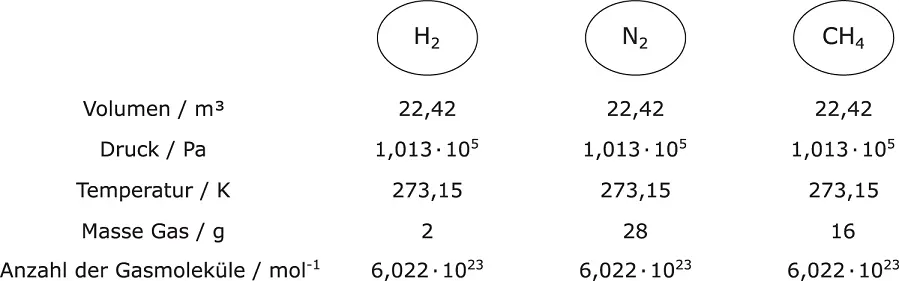
Abbildung 2.9Gesetz von Avogadro
 Wenn Ihnen dieses Beispiel immer noch nicht so recht weiterhelfen sollte, hilft Ihnen vielleicht das folgende praktische Beispiel: Jedes Element hat ein Atomgewicht, das Sie im Periodensystem der Elemente ablesen können. Aluminium (Al) zum Beispiel hat ein Atomgewicht von 26,98 kg/kmol, siehe Abbildung 2.10. Achtung: die Einheit ist im Periodensystem der Elemente nicht angegeben. Wenn Sie Altaluminium sammeln, das Aluminium wiegen und feststellen, dass Sie genau 26,98 kg gesammelt haben, so wird der Chemiker Ihnen mitteilen, dass sie genau 1 kmol Aluminium gesammelt haben. Sie sehen: 1 kmol Aluminium entspricht genau 26,98 kg, wobei 1 mol Aluminium (26,98 g) genau 6,022 · 10 23Teilchen enthält. Daran sehen Sie auch, dass es besser ist, etwas in kg oder kmol zu messen als die Teilchenzahl anzugeben, das wären viel zu große Zahlenwerte.
Wenn Ihnen dieses Beispiel immer noch nicht so recht weiterhelfen sollte, hilft Ihnen vielleicht das folgende praktische Beispiel: Jedes Element hat ein Atomgewicht, das Sie im Periodensystem der Elemente ablesen können. Aluminium (Al) zum Beispiel hat ein Atomgewicht von 26,98 kg/kmol, siehe Abbildung 2.10. Achtung: die Einheit ist im Periodensystem der Elemente nicht angegeben. Wenn Sie Altaluminium sammeln, das Aluminium wiegen und feststellen, dass Sie genau 26,98 kg gesammelt haben, so wird der Chemiker Ihnen mitteilen, dass sie genau 1 kmol Aluminium gesammelt haben. Sie sehen: 1 kmol Aluminium entspricht genau 26,98 kg, wobei 1 mol Aluminium (26,98 g) genau 6,022 · 10 23Teilchen enthält. Daran sehen Sie auch, dass es besser ist, etwas in kg oder kmol zu messen als die Teilchenzahl anzugeben, das wären viel zu große Zahlenwerte.
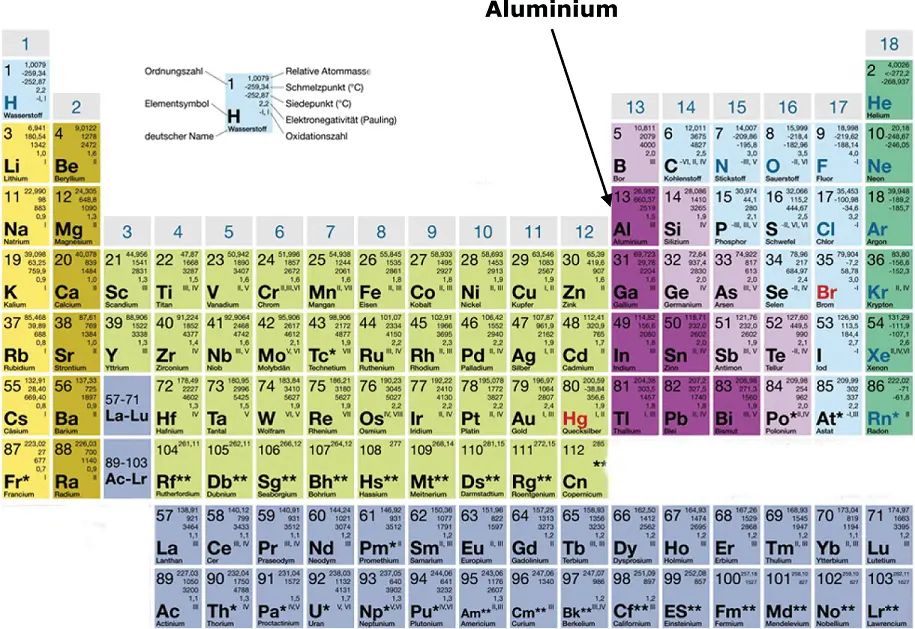
Abbildung 2.10Periodensystem der Elemente mit Aluminium
Stoffmenge n und Masse m lassen sich problemlos ineinander umrechnen:
(2.8) 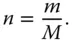
Der Proportionalitätsfaktor ist die für jeden Stoff charakteristischen Molmasse M 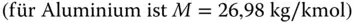 . Somit lässt sich die individuelle Gaskonstante aus der universellen Gaskonstante einfach zu
. Somit lässt sich die individuelle Gaskonstante aus der universellen Gaskonstante einfach zu
(2.9) 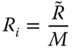
berechnen. Die Gasgesetze können auch mit den Dichten
(2.10) 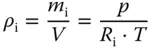
beziehungsweise der molaren Dichte
(2.11) 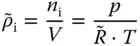
gebildet werden.
Welchen Standard hätten Sie denn gern?
Sowohl der Verfahrenstechniker als auch der Chemiker arbeiten gern mit Standardzuständen. Wie im richtigen Leben ist es aber oft schwierig, den richtigen Standard zu finden, sich auf einen Standard zu einigen (das fällt selbst Ehepaaren schwer). Der Techniker hält sich an STP-Standardbedingungen (Standard Temperature and Pressure). Bei 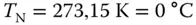 und
und 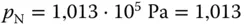 bar nimmt ein Kilomol eines idealen Gases das Volumen von 22,42 m 3ein
bar nimmt ein Kilomol eines idealen Gases das Volumen von 22,42 m 3ein 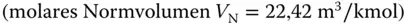 , siehe hierzu auch Abbildung 2.9.
, siehe hierzu auch Abbildung 2.9.
Bei den Chemikern ist das etwas schwieriger. Hier gibt es die chemischen Standardbedingungen der IUPAC mit 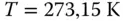 und
und 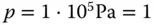 bar. Dies lässt sich zweifelsfrei leichter rechnen als mit den »krummen« 1,013 bar. Das vom Gas eingenommene Volumen weicht logischerweise nicht stark von den STP-Bedingungen ab
bar. Dies lässt sich zweifelsfrei leichter rechnen als mit den »krummen« 1,013 bar. Das vom Gas eingenommene Volumen weicht logischerweise nicht stark von den STP-Bedingungen ab 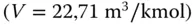 . Weiterhin wird von Chemikern häufig die SATP-Bedingung genutzt. Bei
. Weiterhin wird von Chemikern häufig die SATP-Bedingung genutzt. Bei 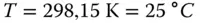 und
und 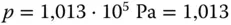 bar nimmt ein ideales Gas ein Volumen von 24,47 m 3/kmol ein.
bar nimmt ein ideales Gas ein Volumen von 24,47 m 3/kmol ein.
Cocktailzeit: Gase können Sie mischen
Wie Sie wissen, lassen sich Gase beliebig ineinander mischen. Werden Druck und Temperatur konstant gehalten, addieren sich die einzelnen Volumina zum Gesamtvolumen:
(2.12) 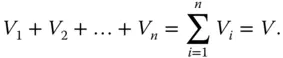
Genauso gilt für den Gesamtdruck, dass er sich aus der Summe der Einzeldrücke der Komponenten zusammensetzt:
(2.13) 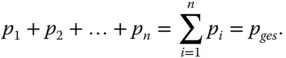
Die Summe aller Einzeldrücke p iergibt den Gesamtdruck p ges. Der Druck, den eine Komponente im System ausübt, wird Partialdruck p igenannt.
Anschaulich ist der Partialdruck in Abbildung 2.11für drei Gaskomponenten ( i = 1, 2, 3) dargestellt. Der Gesamtdruck setzt sich aus der Summe der Einzeldrücke der drei Komponenten zusammen (linkes Bild, Formel 2.13). Werden die beiden gasförmigen Komponenten 2 und 3 aus dem Gefäß entnommen, verringert sich der Druck im Gefäß auf den Druck, den die Komponente 1 allein ausübt. Dies ist der Partialdruck p 1der Komponente 1.
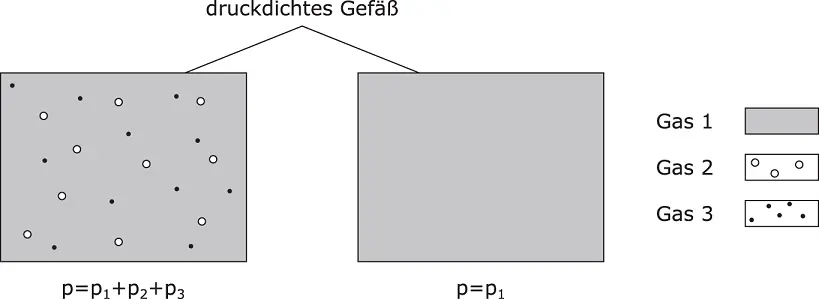
Abbildung 2.11Partialdruck
 Würden Sie aus der Umgebungsluft den Stickstoff herausnehmen, bestünde die Luft nur noch aus Sauerstoff. Da Sauerstoff etwa ein Fünftel des Gesamtvolumens einnimmt, würde der Druck ebenfalls auf circa ein Fünftel absinken.
Würden Sie aus der Umgebungsluft den Stickstoff herausnehmen, bestünde die Luft nur noch aus Sauerstoff. Da Sauerstoff etwa ein Fünftel des Gesamtvolumens einnimmt, würde der Druck ebenfalls auf circa ein Fünftel absinken.
Sättigung von Gasen mit Feuchtigkeit
Gase, speziell Luft, enthalten häufig Wasserdampf. Wäre das nicht der Fall, gäbe es weder Wolken noch Regen. Die aktuell in der Luft mit dem Volumen V enthaltene Wassermenge m Wwird als absolute Luftfeuchtigkeit f in g Wasser/m 3Luft angegeben:
(2.14) 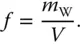
Luft kann in Abhängigkeit von der Temperatur bei konstantem Druck nur eine bestimmte maximale Menge Wasserdampf f maxaufnehmen. Ist diese Menge erreicht, ist die Luft gesättigt. Sie erhalten die Sättigungsmenge oder Sättigungsfeuchte.
Читать дальше


 Wenn Ihnen dieses Beispiel immer noch nicht so recht weiterhelfen sollte, hilft Ihnen vielleicht das folgende praktische Beispiel: Jedes Element hat ein Atomgewicht, das Sie im Periodensystem der Elemente ablesen können. Aluminium (Al) zum Beispiel hat ein Atomgewicht von 26,98 kg/kmol, siehe Abbildung 2.10. Achtung: die Einheit ist im Periodensystem der Elemente nicht angegeben. Wenn Sie Altaluminium sammeln, das Aluminium wiegen und feststellen, dass Sie genau 26,98 kg gesammelt haben, so wird der Chemiker Ihnen mitteilen, dass sie genau 1 kmol Aluminium gesammelt haben. Sie sehen: 1 kmol Aluminium entspricht genau 26,98 kg, wobei 1 mol Aluminium (26,98 g) genau 6,022 · 10 23Teilchen enthält. Daran sehen Sie auch, dass es besser ist, etwas in kg oder kmol zu messen als die Teilchenzahl anzugeben, das wären viel zu große Zahlenwerte.
Wenn Ihnen dieses Beispiel immer noch nicht so recht weiterhelfen sollte, hilft Ihnen vielleicht das folgende praktische Beispiel: Jedes Element hat ein Atomgewicht, das Sie im Periodensystem der Elemente ablesen können. Aluminium (Al) zum Beispiel hat ein Atomgewicht von 26,98 kg/kmol, siehe Abbildung 2.10. Achtung: die Einheit ist im Periodensystem der Elemente nicht angegeben. Wenn Sie Altaluminium sammeln, das Aluminium wiegen und feststellen, dass Sie genau 26,98 kg gesammelt haben, so wird der Chemiker Ihnen mitteilen, dass sie genau 1 kmol Aluminium gesammelt haben. Sie sehen: 1 kmol Aluminium entspricht genau 26,98 kg, wobei 1 mol Aluminium (26,98 g) genau 6,022 · 10 23Teilchen enthält. Daran sehen Sie auch, dass es besser ist, etwas in kg oder kmol zu messen als die Teilchenzahl anzugeben, das wären viel zu große Zahlenwerte.
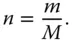
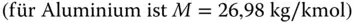 . Somit lässt sich die individuelle Gaskonstante aus der universellen Gaskonstante einfach zu
. Somit lässt sich die individuelle Gaskonstante aus der universellen Gaskonstante einfach zu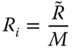
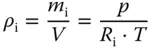
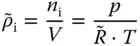
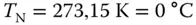 und
und 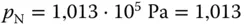 bar nimmt ein Kilomol eines idealen Gases das Volumen von 22,42 m 3ein
bar nimmt ein Kilomol eines idealen Gases das Volumen von 22,42 m 3ein 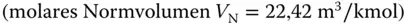 , siehe hierzu auch Abbildung 2.9.
, siehe hierzu auch Abbildung 2.9.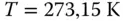 und
und 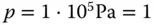 bar. Dies lässt sich zweifelsfrei leichter rechnen als mit den »krummen« 1,013 bar. Das vom Gas eingenommene Volumen weicht logischerweise nicht stark von den STP-Bedingungen ab
bar. Dies lässt sich zweifelsfrei leichter rechnen als mit den »krummen« 1,013 bar. Das vom Gas eingenommene Volumen weicht logischerweise nicht stark von den STP-Bedingungen ab 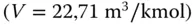 . Weiterhin wird von Chemikern häufig die SATP-Bedingung genutzt. Bei
. Weiterhin wird von Chemikern häufig die SATP-Bedingung genutzt. Bei 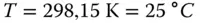 und
und 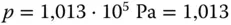 bar nimmt ein ideales Gas ein Volumen von 24,47 m 3/kmol ein.
bar nimmt ein ideales Gas ein Volumen von 24,47 m 3/kmol ein.