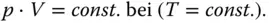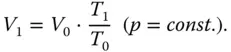Abbildung 2.6zeigt das Teilchenmodell eines Gases. Bei Stoffen im gasförmigem Zustand sind die Teilchen in schneller Bewegung, sie führen eine ungeordnete Brownsche Molekularbewegung aus.
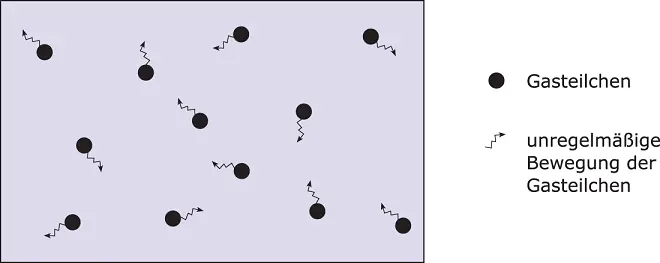
Abbildung 2.6Teilchenmodell eines Gases
In einem geschlossenen Raum führt das Stoßen der Teilchen gegen die Wände zum Druck, den das Gas ausübt. Wenn Sie ein Gas erwärmen, dehnt es sich aus. Wenn Sie das Gas aber in einem konstanten Volumen »einsperren«, zum Beispiel einer Plastikflasche, steigt bei Erwärmung der Druck in der Flasche, da sich das Gas nicht ausdehnen kann. Die Gasteilchen bewegen sich bei Temperaturzunahme immer schneller und stoßen somit häufiger und mit mehr Energie gegen die Wände. Der Druck in der Flasche steigt an. Diesen Druck können Sie mit entsprechenden Druckmessgeräten messen.
Bei Gasen entfällt die Volumenbeständigkeit, ein Gas füllt immer den zur Verfügung stehenden Raum vollständig aus. Die Bewegungsenergie der Teilchen ist so hoch, dass sie nicht mehr zusammenhalten, der gasförmige Stoff verteilt sich gleichmäßig im gesamten zur Verfügung stehenden Raum. Das ist auch gut so. Stellen Sie sich vor, die Luft würde lediglich die Hälfte Ihres Wohnzimmers ausfüllen. Dann müssten Sie immer den Kopf einziehen, wenn Sie atmen wollten. Im Schlafzimmer, wenn Sie im Bett liegen, wäre das hingegen kein so großes Problem.
Die Teilchen sind so weit voneinander entfernt, dass sie nur hin und wieder aneinanderstoßen, im Vergleich zur flüssigen Phase also auf großer Distanz bleiben. Aufgrund ihrer Bewegung sind die Teichen völlig ungeordnet. Gase lassen sich komprimieren, der Abstand zwischen den einzelnen Teilchen lässt sich durch Druckerhöhung reduzieren. Dadurch nähern sich Gase bei Erhöhung des Drucks immer mehr dem flüssigen Zustand an. Wie Sie aus Abbildung 2.2entnehmen können, führt eine Druckerhöhung oder Temperaturerniedrigung zur Verflüssigung des Gases. Durch die Abkühlung verringert sich nämlich die Geschwindigkeit der Teilchen, sie rücken näher zusammen, bis sie den Zustand einer Flüssigkeit erreichen. Weiterhin lassen sich Gase in jedem beliebigen Verhältnis mischen, es entstehen homogene Gemische.
 Luft besteht im Wesentlichen aus einer homogenen Mischung der Moleküle Stickstoff und Sauerstoff.
Luft besteht im Wesentlichen aus einer homogenen Mischung der Moleküle Stickstoff und Sauerstoff.
Wie verhält sich ein ideales Gas?
Aufgrund des großen Abstands der Gasteilchen untereinander können ihre Wechselwirkungen sehr häufig vernachlässigt werden, Gase verhalten sich bei geringem Druck daher näherungsweise ideal. Dies gilt bis zu einem Druck von etwa 20 · 10 5Pa.
Ein ideales Gas erfüllt die Voraussetzungen:
unendlich kleine Abmessungen der Gasteilchen im Vergleich zu den Teilchenabständen,
keine Wechselwirkungen der Teilchen untereinander, also auch keine Anziehungs- oder Abstoßungskräfte,
völlig elastische Stöße untereinander und mit der Wand, wenn sie denn mal zusammenstoßen,
keine Aufnahme von Rotations- oder Schwingungsenergie.
 Ein ideales Gas verhält sich so wie ein Mensch, wenn er allein ist. Er macht das, was ihm gefällt, ohne auf andere Personen zu reagieren. In der Gemeinschaft sieht das dann meist anders aus, das Verhalten wird sehr real, wie bei Gasteilchen, die immer näher zusammenrücken und sich gegenseitig beeinflussen.
Ein ideales Gas verhält sich so wie ein Mensch, wenn er allein ist. Er macht das, was ihm gefällt, ohne auf andere Personen zu reagieren. In der Gemeinschaft sieht das dann meist anders aus, das Verhalten wird sehr real, wie bei Gasteilchen, die immer näher zusammenrücken und sich gegenseitig beeinflussen.
Das ideale Verhalten von Gasen kann mit einfachen Gesetzen beschrieben werden. Das Gesetz von Boyle und Mariotte besagt, dass bei konstanter Temperatur T für eine gleichbleibende Gasmenge das Produkt aus Druck p und Volumen V konstant ist:
(2.1) 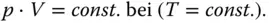
Wird der Druck erhöht, verringert sich das Volumen. Je höher der Druck ist, desto stärker wird das Volumen komprimiert.
 Dieses Verhalten kennen Sie vom Motor Ihres Autos, wenn Sie noch ein Auto mit Verbrennungsmotor fahren. Der Kolben wandert nach oben und verdichtet das Gas, das Gasvolumen wird verringert, der Druck ist maximal. Dann wird das Gas gezündet, das Volumen vergrößert sich, der Kolben bewegt sich nach unten und treibt die Kurbelwelle Ihres Autos an.
Dieses Verhalten kennen Sie vom Motor Ihres Autos, wenn Sie noch ein Auto mit Verbrennungsmotor fahren. Der Kolben wandert nach oben und verdichtet das Gas, das Gasvolumen wird verringert, der Druck ist maximal. Dann wird das Gas gezündet, das Volumen vergrößert sich, der Kolben bewegt sich nach unten und treibt die Kurbelwelle Ihres Autos an.
Das Gesetz von Gay-Lussac beschreibt die Abhängigkeit des Volumens von der Temperatur bei konstantem Druck:
(2.2) 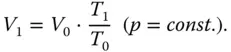
V 1ist das gesuchte Volumen, das sich bei einer Temperaturänderung vom Ausgangszustand T 0auf die Temperatur T 1aus dem Ausgangsvolumen V 0ergibt. Lassen Sie den Druck konstant, nimmt ein wärmeres Gas ein größeres Volumen ein. Die Gasteilchen bewegen sich schneller, wodurch der Abstand zwischen den Teilchen vergrößert wird.
 Bei unterschiedlich beheizten Räumen können Sie beobachten, wie Luft vom warmen zum kalten Raum strömt, da sich das Luftvolumen im warmen Raum vergrößert. Durch geschlossene Türen können Sie diesen Luftaustausch verhindern, sodass die gewünschten unterschiedlichen Raumtemperaturen beibehalten werden können.
Bei unterschiedlich beheizten Räumen können Sie beobachten, wie Luft vom warmen zum kalten Raum strömt, da sich das Luftvolumen im warmen Raum vergrößert. Durch geschlossene Türen können Sie diesen Luftaustausch verhindern, sodass die gewünschten unterschiedlichen Raumtemperaturen beibehalten werden können.
Bei Luftmatratzen beobachten Sie, wie sie sich stärker aufblasen, wenn sie in der Sonne liegen. Die Luft in der Matratze dehnt sich aus. Da die Luftmatratze aber ein abgeschlossener Raum ist, sodass sich das Gas nur bedingt ausdehnen kann, erhöht sich der Druck. Dies kann im Extremfall bis zum Platzen führen.
Abbildung 2.7zeigt in drei Schaubildern das Verhalten idealer Gase als Funktion von Druck p , Temperatur T und Volumen V .
Bei konstantem Volumen nimmt die Temperatur linear mit einer Druckerhöhung zu. Wenn Sie den Druck erhöhen, bewegen sich die Gasteilchen schneller. Warum erhöht sich dann aber die Temperatur? Hier müssen Sie kurz noch etwas über die Temperaturmessung lernen, sozusagen im Schnelldurchgang. Ein Temperaturfühler reagiert auf den »Beschuss« von Molekülen. Je öfter und mit höherer Energie Partikel auf den Temperatursensor treffen, desto höher ist die Temperatur. Wenn Sie also den Druck erhöhen, treffen die Gasmoleküle häufiger und mit höherer Energie auf den Temperatursensor, der Temperaturanstieg wird angezeigt.
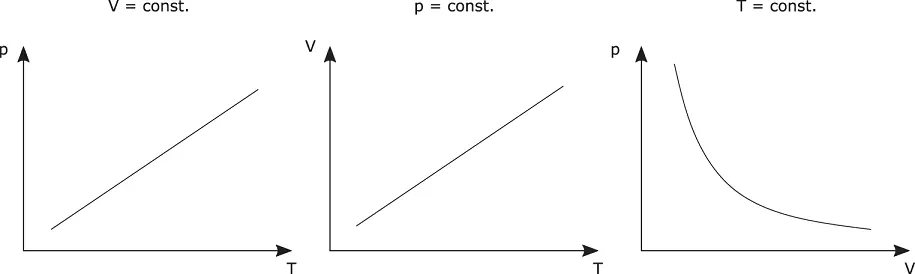
Abbildung 2.7Verhalten von idealen Gasen
Genauso nimmt das Volumen V bei konstantem Druck bei einer Temperaturerhöhung linear zu. Dies verstehen Sie mittlerweile auch: wird die Temperatur erhöht, bewegen sich die Gasmoleküle schneller, sie verlassen den ihnen zugedachten Raum, das Volumen vergrößert sich.
Wird die Temperatur konstant gehalten, führt eine Druckerhöhung zu einer Volumenverringerung. Diese Abhängigkeit ist nichtlinear. Wenn Sie das Volumen eines Gases verringern, rücken die Moleküle immer näher zusammen, siehe Formel 2.1. Um die Teilchenabstände noch weiter zu verringern, ist ein überproportional hoher Druck erforderlich. Je weiter die Gasteilchen zusammengerückt sind, desto schwieriger wird es, sie noch weiter zu verdichten. Dadurch ergibt sich der nichtlineare Zusammenhang.
Читать дальше


 Luft besteht im Wesentlichen aus einer homogenen Mischung der Moleküle Stickstoff und Sauerstoff.
Luft besteht im Wesentlichen aus einer homogenen Mischung der Moleküle Stickstoff und Sauerstoff.