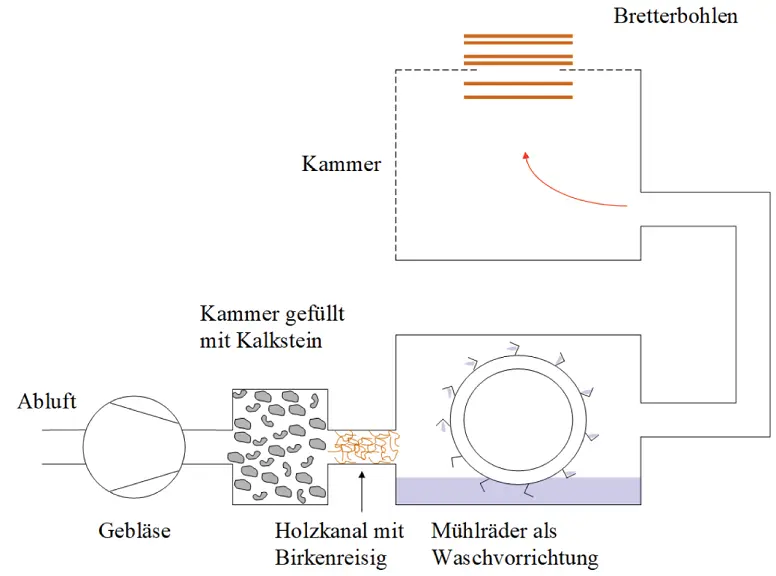
Abbildung 1.9Abluftreinigung einer Ultramarinfabrik
»Besonders erwähnenswert ist das Beispiel einer sächsischen Ultramarinfabrik, die noch vor wenigen Jahren ihrer Waldumgebung ungemein gefährlich war, heute aber vollen Erfolg mit der Kombination von Entsäuerung mit Luftverdünnung erzielt hat. Die Abgase werden zunächst durch große, mit Kalkstein gefüllte Kammern mittels eines Ventilators hindurchgetrieben und so der ursprünglich sehr hohe Säuregehalt beträchtlich herabgesetzt, aber nicht ganz entfernt. Statt die Restgase durch den Schornstein in die Luft abzuführen, werden sie durch einen langen mit Birkenreisig gefüllten Holzkanal noch zu einer weiteren Waschvorrichtung, wo sie große, über Mühlräder stürzende Wassermassen passieren, geführt und schließlich durch die zahlreichen Ritzen einer aus losen Bretterbohlen gebildeten geräumigen Kammer an die Luft entlassen. Es entweicht nur ein feiner Nebel mit wenig Schwefelsäure beziehungsweise SO 3, der an Schädlichkeit nicht mit den ursprünglichen Schwefelsäuregasen vergleichbar ist«.
Es handelte sich bei der Anlage somit um ein frühes verfahrenstechnisches Konzept, das aus Adsorption mit chemischer Umsetzung am Kalk, einem Biofilter (Holzkanal mit Birkenreisig), einer Absorption mit Wasser als Absorbens (Mühlräder) sowie einem Tropfenabscheider (Kammer mit Bretterbohlen) bestand, siehe Abbildung 1.9. Heutige Verfahrensingenieure werden sich ob dieser Anlagenschaltung vor Freude auf die Schenkel schlagen und aus dem Lachen nicht mehr herauskommen. Damals fehlten aber die wissenschaftlichen Grundlagen (die Sie spätestens nach dem Lesen dieses Buchs kennen werden), es wurde nur gebaut, was bekannt war. Und dass basischer Kalkstein Säure bindet, wusste man bereits damals. Auch Mühlräder waren bekannt, konnten daher wohl auch bei der Abgasreinigung nicht schaden.
Chemische Produkte wurden in der industriellen Produktion immer wichtiger. So entwickelte der Chemiker Baekeland 1909 ein Verfahren zur Herstellung des ersten hochvernetzten duroplastischen Kunststoffs, des so genannten Bakelits. Im gleichen Jahr wird das Haber-Bosch-Verfahren zur Herstellung von Ammoniak großtechnisch entwickelt, die Grundlage für eine gewaltige weltweite Ertragssteigerung in der Landwirtschaft durch die wirtschaftliche Bereitstellung von Düngemitteln. Die Zusammenarbeit des Chemikers Haber, der die chemische Reaktion entwickelte, und des Ingenieurs Bosch, der für die praktische Umsetzung und die Beherrschung der hohen Drücke verantwortlich war, setzte hier Maßstäbe. Es wurde zunehmend deutlich, dass ein Ingenieur für die technische Umsetzung chemischer Verfahren erforderlich war. Ja genau: ein Verfahrensingenieur!
Die Entwicklung der Verfahrenstechnik
In Deutschland gab es im 19. Jahrhundert lediglich das Fachgebiet der chemischen Technologie, die Verfahrensbeschreibungen vom Rohstoff bis zum Endprodukt lieferte. Das Konzept der Unit Operations wurde erst 1893 von Lunge in Zürich und 1915 von Arthur D. Little am Massachusetts Institute of Technology (MIT) formuliert. Hier gab es ab 1880 auch den ersten Chemical Engineer. Erste Vorlesungen zur Verfahrenstechnik wurden in Deutschland 1928 von Kirschbaum an der damaligen TH Karlsruhe angeboten. Kirschbaum leitete ab 1941 das erste verfahrenstechnische Institut, das »Institut für Apparatebau und Verfahrenstechnik«. 1935 wurde vom VDI die »Arbeitsgemeinschaft für Verfahrenstechnik«, später »Fachausschuss Verfahrenstechnik«, ins Leben gerufen, die Verfahrenstechnik etablierte sich langsam als wissenschaftliches Arbeitsgebiet. Es dauerte, bedingt durch den 2. Weltkrieg, allerdings bis zum Jahr 1952, als in Aachen das erste Institut für Verfahrenstechnik gegründet wurde. Seit 1959 wird Verfahrenstechnik an allen bedeutenden technischen Hochschulen angeboten.
Kapitel 2
IN DIESEM KAPITEL
Lernen Sie Phasen und Gemische kennen
Lernen Sie alles über Aggregatzustände
Wird Ihnen das ideale Gasgesetz vorgestellt
Lernen Sie das Teilchenmodell kennen
Werden Sie erfahren, was ein Mol ist
Sehen Sie, warum Phasenübergänge in der Verfahrenstechnik wichtig sind
Zuerst müssen Sie einige verfahrenstechnische Grundlagen definieren, sozusagen das Fundament gießen, auf dem die Verfahrenstechnik steht. Die hierbei beschriebenen Begriffe benötigen Sie immer wieder.
Phasen und Gemische
Phase, verfahrenstechnisch gesehen
Die elektrotechnische Phase interessiert uns hier überhaupt nicht! Uns ist es egal, in welche Richtung der Strom fließt, ob von Plus nach Minus oder umgekehrt. Und in welcher Phase der Mond gerade steht, kümmert uns erst recht nicht. Aber auch in der Verfahrenstechnik gibt es Phasen, und die interessieren uns sehr. So findet bei Stoffumwandlungsprozessen häufig ein Phasenwechsel statt.
 Sie wissen, dass Alkohol bei der Destillation aus der Flüssigkeit in den dampfförmigen Zustand übergeht und so von der flüssigen Phase Wasser getrennt werden kann.
Sie wissen, dass Alkohol bei der Destillation aus der Flüssigkeit in den dampfförmigen Zustand übergeht und so von der flüssigen Phase Wasser getrennt werden kann.
Jetzt ahnen Sie schon, wie eine Phase definiert ist:
 Eine Phase ist ein homogener Teil eines Systems.
Eine Phase ist ein homogener Teil eines Systems.
Homogen bedeutet, dass die physikalischen Größen sich in einer Phase nicht sprunghaft ändern. Schauen Sie sich die Dichte an: innerhalb einer Phase ändert sich die Dichte nicht. Stoßen aber zwei Phasen aneinander, wie beispielsweise Gas und Flüssigkeit, so ändert sich die Dichte an der Phasengrenze sprunghaft. Die Dichte einer Flüssigkeit ist etwa 1000-mal so groß wie die des Gases.
Phasen kommen als
feste,
flüssige oder
gasförmige
Aggregatzustände vor. Eine Phase kann als
reine Phase oder als
Mischphase
vorliegen.
 Während eine reine Phase nur aus einer Komponente besteht (zum Beispiel Wasser), besteht eine Mischphase aus mehreren Komponenten (zum Beispiel besteht die Mischphase Luft im Wesentlichen aus den Komponenten Sauerstoff und Stickstoff).
Während eine reine Phase nur aus einer Komponente besteht (zum Beispiel Wasser), besteht eine Mischphase aus mehreren Komponenten (zum Beispiel besteht die Mischphase Luft im Wesentlichen aus den Komponenten Sauerstoff und Stickstoff).
Homogene und heterogene Gemische
In der Verfahrenstechnik werden häufig Stoffgemische getrennt. Sie müssen dabei unterscheiden zwischen
homogenen und
heterogenen
Gemischen.
Ein homogenes Gemisch besteht aus einer Phase, normalerweise einer Mischphase. Ein heterogenes Gemisch ist dagegen ein Mehrphasensystem.
 Mehrphasensysteme sind aus mehr als einer Phase zusammengesetzt, wie zum Beispiel
Mehrphasensysteme sind aus mehr als einer Phase zusammengesetzt, wie zum Beispiel
Nebel (gasförmig/flüssig),
Rauch (gasförmig/fest, kennt jeder Raucher),
Schaum (flüssig/gasförmig, besonders beliebt bei Biertrinkern, wenn sie nicht gerade aus England kommen),
Suspensionen (flüssig/fest, wenn Sie beim Bier bleiben, ist das die feste Hefe im Hefeweizen).
Abbildung 2.1verdeutlicht den Zusammenhang. Links sehen Sie die homogene Mischphase Luft, die aus den gasförmigen Komponenten Stickstoff und Sauerstoff besteht. Als Beispiel für ein heterogenes Stoffgemisch sehen Sie rechts Luft, in der sich Feststoffpartikel befinden. Heterogene Gemische bestehen daher immer aus mehreren Phasen, während homogene Gemische aus nur einer Phase bestehen.
Читать дальше


 Sie wissen, dass Alkohol bei der Destillation aus der Flüssigkeit in den dampfförmigen Zustand übergeht und so von der flüssigen Phase Wasser getrennt werden kann.
Sie wissen, dass Alkohol bei der Destillation aus der Flüssigkeit in den dampfförmigen Zustand übergeht und so von der flüssigen Phase Wasser getrennt werden kann. Eine Phase ist ein homogener Teil eines Systems.
Eine Phase ist ein homogener Teil eines Systems.










