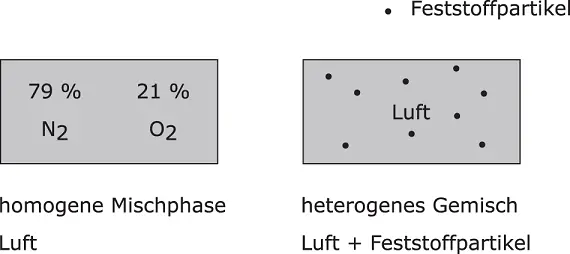
Abbildung 2.1Homogene und heterogene Gemische
Grundlegende Überlegungen zu Aggregatzuständen
»Zustände sind das hier!« Wer kennt diesen Ausruf nicht. Wir Verfahrenstechniker wissen, was damit gemeint ist: der Aggregatzustand.
 Ein Aggregatzustand ist die Erscheinungs- und Zustandsform, in der die Materie existiert.
Ein Aggregatzustand ist die Erscheinungs- und Zustandsform, in der die Materie existiert.
Das hört sich sehr vernünftig an. Aber wie wissen Sie denn, welchen Aggregatzustand ein bestimmter Stoff einnimmt? Der Aggregatzustand ist abhängig von dem Stoff, den Sie betrachten. Außerdem ist er temperatur- und druckabhängig. Ändern Sie den Druck oder die Temperatur, kann sich der Aggregatzustand eines Stoffs ändern.
 Sie wissen, dass Sie bei Wasser den flüssigen Aggregatzustand durch Temperaturänderung ändern können zu fest (Eis) oder gasförmig (Dampf).
Sie wissen, dass Sie bei Wasser den flüssigen Aggregatzustand durch Temperaturänderung ändern können zu fest (Eis) oder gasförmig (Dampf).
Wie können Sie aber für einen bestimmten Stoff darstellen, wie er sich bei Änderung von Druck und Temperatur verhält? Sie merken vermutlich schon, wie wichtig das ist. Sie wollen doch wissen, wann der Alkohol verdampft, damit Sie ihn rein gewinnen können!
Zur Darstellung können Sie sich sogenannter Phasendiagramme bedienen. In Phasendiagrammen wird die Abhängigkeit des Aggregatzustands (oder des enger gefassten Begriffs der Phase) von verschiedenen Einflussgrößen gezeigt. Das Phasendiagramm ist ein Hilfsmittel für die Veranschaulichung von Zuständen und den zugehörigen Phasen.
Die Aggregatzustände reiner Stoffe lassen sich im p , T -Diagramm veranschaulichen. Abbildung 2.2zeigt ein solches Phasendiagramm. Aufgetragen ist der Druck p über der Temperatur T .
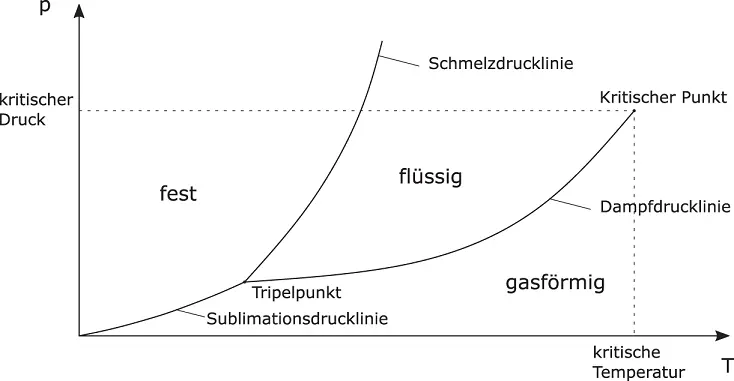
Abbildung 2.2Allgemeine Form eines Phasendiagramms
Die Aggregatzustände sind durch die Linien (Kurven)
Dampfdrucklinie zwischen gasförmigem und flüssigem Zustand,
Schmelzdrucklinie zwischen flüssigem und festem Zustand sowie
Sublimationsdrucklinie zwischen gasförmigem und festem Zustand
getrennt. Die drei Linien schneiden sich im für jeden Stoff charakteristischen Tripelpunkt: Gas, Flüssigkeit und Feststoff stehen hier miteinander im Gleichgewicht. Die Dampfdrucklinie endet im kritischen Punkt, oberhalb dessen keine klare Unterscheidung zwischen Gas und Flüssigkeit mehr möglich ist, da die Dichten sich einander annähern.
 Anbei finden Sie einige Beispiele für den kritischen Punkt:
Anbei finden Sie einige Beispiele für den kritischen Punkt:
Helium: 1,96 bar, –268 °C,
Wasserstoff: 12,75 bar, –240 °C,
Stickstoff: 33,34 bar, –147 °C,
Sauerstoff: 49 bar, –119 °C,
Kohlenstoffdioxid: 73,55 bar, 31 °C,
Ammoniak: 116,7 bar, 132 °C,
Wasser: 220,6 bar, 374 °C.
Das Phasendiagramm gibt Ihnen Auskunft, welchen Aggregatzustand ein Stoff bei bekanntem Druck und bekannter Temperatur einnimmt. Außerdem können Sie ablesen, was passiert, wenn Sie Druck oder Temperatur ändern.
Die Phasenübergänge zwischen den drei Aggregatzuständen sind in Abbildung 2.3gezeigt. Es gilt:
Erstarren: Phasenübergang flüssig-fest,
Schmelzen: Phasenübergang fest-flüssig,
Verdampfen: Phasenübergang flüssig-gasförmig,
Kondensieren: Phasenübergang gasförmig-flüssig,
Sublimieren: Phasenübergang fest-gasförmig,
Resublimieren: Phasenübergang gasförmig-fest.
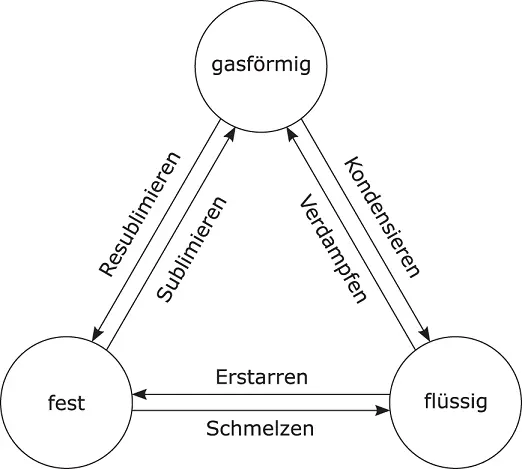
Abbildung 2.3Übergänge zwischen den drei Aggregatzuständen
 Beispielhaft zeigt Abbildung 2.4das p , T -Diagramm für Wasser. Der Tripelpunkt liegt bei T = 273,16 K, p = 0,061 · 10 5Pa. Hier stehen Eis, Wasser und Wasserdampf miteinander im Gleichgewicht. Der kritische Punkt, oberhalb dessen keine klare Unterscheidung zwischen Gas und Flüssigkeit mehr möglich ist, befindet sich bei T = 647,1 K, p = 220,6 · 10 5Pa, also bei verhältnismäßig hohen Werten. Sie wissen, dass Wasser bei einem Druck von 1 · 10 5Pa bei 373,15 K siedet. Dieser Punkt liegt genau auf der Dampfdrucklinie. Auf der Dampfdrucklinie liegen alle Siedepunkte des Wassers. Oder anders ausgedrückt: wenn Sie bei einem bestimmten Druck auf die Siedelinie gehen, können Sie die entsprechende Siedetemperatur ablesen.
Beispielhaft zeigt Abbildung 2.4das p , T -Diagramm für Wasser. Der Tripelpunkt liegt bei T = 273,16 K, p = 0,061 · 10 5Pa. Hier stehen Eis, Wasser und Wasserdampf miteinander im Gleichgewicht. Der kritische Punkt, oberhalb dessen keine klare Unterscheidung zwischen Gas und Flüssigkeit mehr möglich ist, befindet sich bei T = 647,1 K, p = 220,6 · 10 5Pa, also bei verhältnismäßig hohen Werten. Sie wissen, dass Wasser bei einem Druck von 1 · 10 5Pa bei 373,15 K siedet. Dieser Punkt liegt genau auf der Dampfdrucklinie. Auf der Dampfdrucklinie liegen alle Siedepunkte des Wassers. Oder anders ausgedrückt: wenn Sie bei einem bestimmten Druck auf die Siedelinie gehen, können Sie die entsprechende Siedetemperatur ablesen.
Die Anomalie des Wassers sorgt dafür, dass die Schmelzdrucklinie leicht nach links gekippt ist, was bei Stoffen ohne diese Anomalie nicht der Fall ist (sehen Sie sich hierzu Abbildung 2.2an).
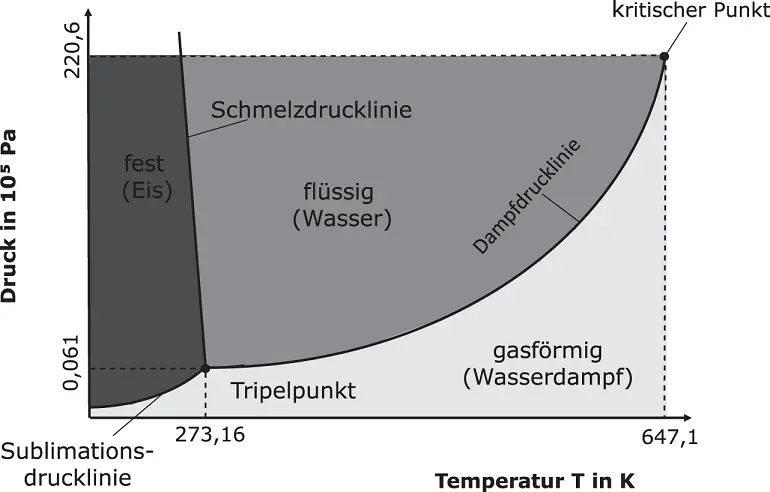
Abbildung 2.4 p , T -Diagramm für Wasser
Was ist nun aber die Anomalie des Wassers? Ist Wasser nicht ein ganz normaler Stoff? Es ist doch aus dem täglichen Leben gar nicht wegzudenken. Und komisch ist Wasser doch auch nicht, oder? Wasser hat aber tatsächlich besondere Eigenschaften, die es von allen anderen Flüssigkeiten unterscheiden, insbesondere die folgende: Wasser hat bei 4 °C sein kleinstes Volumen und damit seine größte Dichte (und nicht bei 0 °C, wo Wasser zu Eis gefriert). Dieses nicht normale thermische Verhalten von Wasser wird in der Physik als Anomalie des Wassers bezeichnet ( Abbildung 2.5). Die Dichteanomalie führt dazu, dass Wasser sich bei Temperaturen unter 4 °C ausdehnt. Eis hat daher eine geringere Dichte als Wasser. Irgendjemand muss sich dabei etwas gedacht haben, denn dadurch schwimmt Eis im Winter oben und versinkt nicht im Wasser, die Fische haben eine gute Überlebenschance und Sie können im Winter auf einem zugefrorenen See Schlittschuh laufen. Würde Wasser sich verhalten wie alle anderen Stoffe, wäre der Feststoff Eis schwerer als die Flüssigkeit Wasser und Sie müssten am Grund des Sees Schlittschuh laufen. So aber hat das 4 °C kalte Wasser die größte Dichte, ist am schwersten, befindet sich also immer am Grund eines Sees. Darum befinden sich Fische im Winter am Seegrund: Hier ist es am wärmsten, es lässt sich relativ gut überwintern.
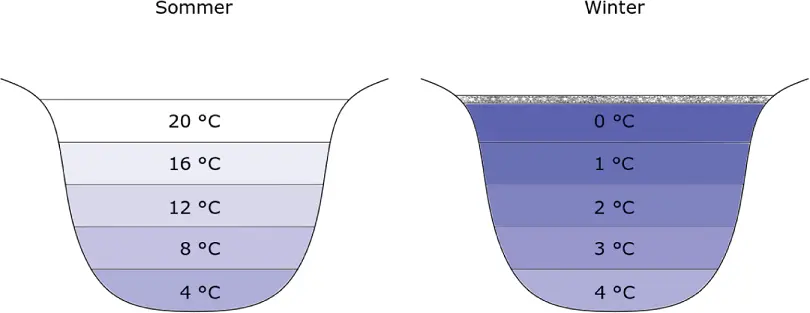
Abbildung 2.5Anomalie des Wassers
Teilchenmodell zur Beschreibung der Aggregatzustände
Die verschiedenen Aggregatzustände lassen sich gut mit dem Teilchenmodell erklären, welches Sie in den nächsten Abschnitten kennenlernen. Beim Teilchenmodell wird davon ausgegangen, dass ein Stoff aus kleinen, kugelförmigen Teilchen besteht. Diese Teilchen können Atome, Moleküle oder Ionen sein.
Читать дальше


 Ein Aggregatzustand ist die Erscheinungs- und Zustandsform, in der die Materie existiert.
Ein Aggregatzustand ist die Erscheinungs- und Zustandsform, in der die Materie existiert. Sie wissen, dass Sie bei Wasser den flüssigen Aggregatzustand durch Temperaturänderung ändern können zu fest (Eis) oder gasförmig (Dampf).
Sie wissen, dass Sie bei Wasser den flüssigen Aggregatzustand durch Temperaturänderung ändern können zu fest (Eis) oder gasförmig (Dampf).














