gezeigt.
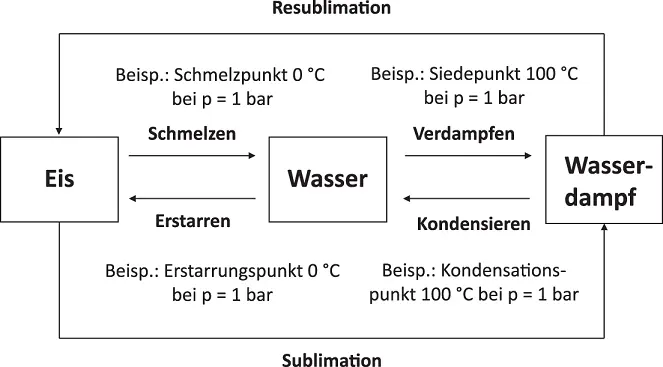
Abbildung 2.17Phasenübergänge am Beispiel von Wasser
Bei Umgebungsdruck (1 bar) erstarrt Wasser bei 0 °C, es bildet sich Eis. Dieses schmilzt bei genau dieser Temperatur. Genauso verhält es sich beim Verdampfen von Wasser. Bei 100 °C wird aus Wasser Wasserdampf. Beim Umkehrvorgang kondensiert Wasserdampf ebenfalls bei 100 °C zu Wasser. Bei Phasenübergängen muss Wärme zugeführt werden (Verdampfen und Schmelzen) oder es wird Wärme frei (Erstarren und Kondensieren).
In Abbildung 2.18ist die Zustandsänderung von Wasser bei Wärmezufuhr gezeigt. Der Startpunkt liegt beispielhaft bei –50 °C. Jetzt führen Sie dem Eis eine bestimmte Wärmemenge Q (Einheit kJ/kg) zu. Dadurch erwärmt sich der Feststoff Eis. Eis besitzt eine spezifische Wärmekapazität von 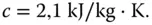
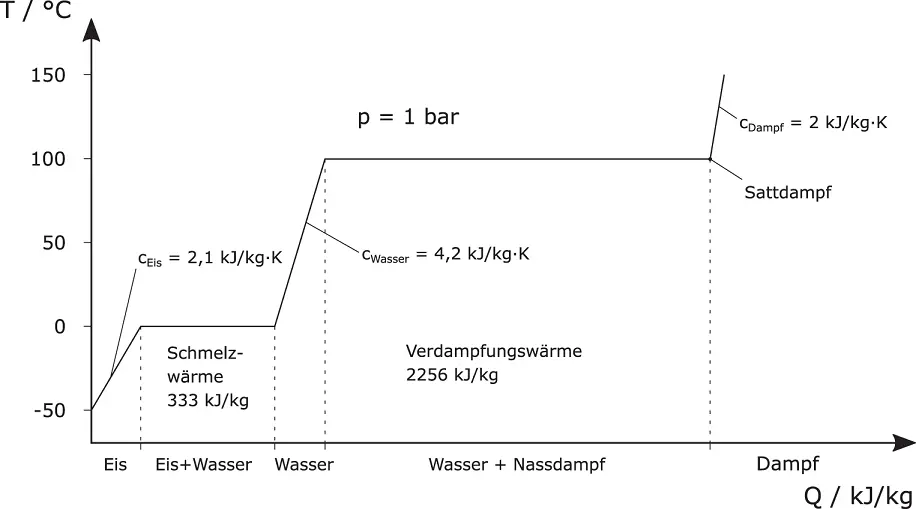
Abbildung 2.18Zustandsänderung von Wasser bei Wärmezufuhr
 Die spezifische Wärmekapazität ist ein Stoffwert und gibt an, wieviel Energie in kJ einem kg des betrachteten Stoffs (hier Eis) zugeführt werden muss, um eine Temperaturerhöhung um 1 K zu erreichen.
Die spezifische Wärmekapazität ist ein Stoffwert und gibt an, wieviel Energie in kJ einem kg des betrachteten Stoffs (hier Eis) zugeführt werden muss, um eine Temperaturerhöhung um 1 K zu erreichen.
Um 1 kg Eis von –50 °C auf 0 °C zu erwärmen, sind daher 105 kJ (50 K · 2,1 kJ/K) erforderlich.
Wird durch Wärmezufuhr eine Temperatur von 0 °C erreicht, beginnt Eis zu schmelzen. Für das Schmelzen des Eises ist Energie erforderlich, die Schmelzwärme. Diese beträgt beim Phasenübergang Eis (Feststoff) zu Wasser (Flüssigkeit) 333 kJ/kg. Jedem kg Eis müssen Sie 333 kJ an Energie zuführen, damit es schmilzt. Erstarrt Wasser zu Eis, wird genau diese Wärmemenge frei. Durch weitere Energiezufuhr wird das Wasser von 0 °C auf 100 °C erwärmt. Zum Erwärmen von Wasser ist viel Energie erforderlich, da Wasser eine sehr hohe Wärmekapazität von 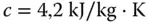 aufweist. Dadurch kann Wasser sehr viel Wärme aufnehmen, ohne sich merklich zu erwärmen.
aufweist. Dadurch kann Wasser sehr viel Wärme aufnehmen, ohne sich merklich zu erwärmen.
 Bedingt durch seine hohe Wärmekapazität eignet sich Wasser sehr gut als Kühlmittel in Wärmeaustauschern. Morgens beim Frühstück haben Sie dafür das Problem, das Sie dem Wasser sehr viel Energie zuführen müssen, damit es kocht und Sie Ihren Tee oder Kaffee aufbrühen können. Schalten Sie Ihren Wasserkocher ein und beobachten Sie Ihren Stromzähler! Sie werden sehen, wie schnell der sich dann dreht.
Bedingt durch seine hohe Wärmekapazität eignet sich Wasser sehr gut als Kühlmittel in Wärmeaustauschern. Morgens beim Frühstück haben Sie dafür das Problem, das Sie dem Wasser sehr viel Energie zuführen müssen, damit es kocht und Sie Ihren Tee oder Kaffee aufbrühen können. Schalten Sie Ihren Wasserkocher ein und beobachten Sie Ihren Stromzähler! Sie werden sehen, wie schnell der sich dann dreht.
Ab 100 °C beginnt Wasser zu verdampfen. Hierzu ist die Verdampfungswärme von 2256 kJ/kg erforderlich. Sie merken, Wasser lässt sich nur mit großem Energieaufwand verdampfen. Ist der letzte Wassertropfen verdampft, wird der Dampf bei weiterer Energiezufuhr immer heißer. Für Dampf beträgt die spezifische Wärmekapazität 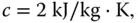 diese liegt also in einer ähnlichen Größenordnung wie beim Eis.
diese liegt also in einer ähnlichen Größenordnung wie beim Eis.
Der Begriff des Siedens ist Ihnen sicher geläufig. Sie wissen, wann Wasser siedet, obwohl hier landläufig von »kochen« gesprochen wird. Kochen ist zwar grammatikalisch richtig, physikalisch aber falsch. Kochen tut der Koch (oder die Köchin, die sind aber zumindest im TV seltsamerweise in der Unterzahl), er kocht Speisen, und zwar möglichst so, dass sie Ihnen schmecken. Wenn Sie eine Flüssigkeit aber so weit erhitzen, dass sich Dampfblasen bilden, sollten Sie das als Verfahrenstechniker als Sieden bezeichnen.
Das Sieden von Flüssigkeiten ist dadurch gekennzeichnet, dass Dampfblasen aus dem Inneren der Flüssigkeit aufsteigen. Diese können die Flüssigkeit nur verlassen, wenn der Dampfdruck in ihnen mindestens so groß ist wie der von außen wirkende Druck.
 Eine Flüssigkeit siedet, wenn ihr Dampfdruck mindestens gleich dem Umgebungsdruck ist.
Eine Flüssigkeit siedet, wenn ihr Dampfdruck mindestens gleich dem Umgebungsdruck ist.
Der Siedepunkt ist die Temperatur, bei der die Flüssigkeit zu sieden beginnt. Der Siedepunkt ist von der Flüssigkeit abhängig, die Sie zum Sieden bringen wollen.
 Für Umgebungsdruck gelten folgende Siedepunkte:
Für Umgebungsdruck gelten folgende Siedepunkte:
Helium: –269 °C,
Stickstoff: –196 °C,
Sauerstoff: –183 °C,
Methan: –162 °C,
Chlor: –34 °C,
Methanol: 64,7 °C,
Ethanol: 78,3 °C,
Wasser: 100 °C,
Schwefelsäure: 290 °C,
Schwefel: 445 °C,
Aluminium: 2470 °C.
 Sie sehen, dass Ethanol und Wasser unterschiedliche Siedepunkte haben. Dies können Sie ausnutzen, um reinen Alkohol zu erzeugen. Sie müssen das Wasser-Alkohol-Gemisch nur auf eine Temperatur zwischen 78 °C und 100 °C erhitzen, damit der Alkohol verdampft, das Wasser dagegen nicht.
Sie sehen, dass Ethanol und Wasser unterschiedliche Siedepunkte haben. Dies können Sie ausnutzen, um reinen Alkohol zu erzeugen. Sie müssen das Wasser-Alkohol-Gemisch nur auf eine Temperatur zwischen 78 °C und 100 °C erhitzen, damit der Alkohol verdampft, das Wasser dagegen nicht.
Den Siedepunkt einer reinen Flüssigkeit können Sie verschieben. Dazu benötigen Sie weniger Kraft, als wenn Sie Ihr Sofa verschieben wollen. Zur Siedepunktverschiebung müssen Sie bloß schwerer lösliche oder unlösliche Stoffe in die Flüssigkeit geben. Wird eine nichtflüchtige Substanz in einer Flüssigkeit gelöst, sinkt der Dampfdruck. Dieser Vorgang wird als Dampfdruckerniedrigung bezeichnet. Sinkender Dampfdruck bedeutet, dass weniger Dampf aus der Flüssigkeit entweicht, der Siedepunkt verschiebt sich dadurch zu höheren Temperaturen.
 Sie wollen Spaghetti kochen. Um den Geschmack der Spaghetti zu erhöhen, geben Sie Salz als Feststoff, also als nichtflüchtige Substanz, in das Wasser. Sie wollen primär nicht den Siedepunkt verschieben, das Würzmittel Salz ist vielmehr für den Geschmack der Spaghetti erforderlich. Das gelöste Salz verteilt sich gleichmäßig im Wasser. Nun wirken nicht nur die Anziehungskräfte zwischen den Wassermolekülen: mit einem Mal ist auch noch ein fremder Stoff da! Jetzt entsteht eine zusätzliche Anziehungskraft zwischen den Wassermolekülen und den Salzatomen. Die Salzatome binden das Wasser zusätzlich. Dadurch wird es für die Wassermoleküle schwieriger, aus dem Wasser zu verdampfen, die Austrittsarbeit der Wassermoleküle wird durch das Salz erhöht. Die höhere Austrittsarbeit bewirkt, dass bei gleicher Temperatur weniger Moleküle des Wassers von der flüssigen in die gasförmige Phase übertreten können als bei der reinen Substanz. Das führt zu der Konsequenz, dass Sie die Temperatur erhöhen müssen, damit gleich viel Wasser verdampft, der Siedepunkt hat sich erhöht. Aber keine Sorge, Ihr Salzwasser siedet bei normaler Salzzugabe bei etwa 101 °C, den Unterschied bemerken Sie beim Kochen überhaupt nicht (und auch nicht in der Stromrechnung).
Sie wollen Spaghetti kochen. Um den Geschmack der Spaghetti zu erhöhen, geben Sie Salz als Feststoff, also als nichtflüchtige Substanz, in das Wasser. Sie wollen primär nicht den Siedepunkt verschieben, das Würzmittel Salz ist vielmehr für den Geschmack der Spaghetti erforderlich. Das gelöste Salz verteilt sich gleichmäßig im Wasser. Nun wirken nicht nur die Anziehungskräfte zwischen den Wassermolekülen: mit einem Mal ist auch noch ein fremder Stoff da! Jetzt entsteht eine zusätzliche Anziehungskraft zwischen den Wassermolekülen und den Salzatomen. Die Salzatome binden das Wasser zusätzlich. Dadurch wird es für die Wassermoleküle schwieriger, aus dem Wasser zu verdampfen, die Austrittsarbeit der Wassermoleküle wird durch das Salz erhöht. Die höhere Austrittsarbeit bewirkt, dass bei gleicher Temperatur weniger Moleküle des Wassers von der flüssigen in die gasförmige Phase übertreten können als bei der reinen Substanz. Das führt zu der Konsequenz, dass Sie die Temperatur erhöhen müssen, damit gleich viel Wasser verdampft, der Siedepunkt hat sich erhöht. Aber keine Sorge, Ihr Salzwasser siedet bei normaler Salzzugabe bei etwa 101 °C, den Unterschied bemerken Sie beim Kochen überhaupt nicht (und auch nicht in der Stromrechnung).
Читать дальше


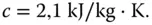

 Die spezifische Wärmekapazität ist ein Stoffwert und gibt an, wieviel Energie in kJ einem kg des betrachteten Stoffs (hier Eis) zugeführt werden muss, um eine Temperaturerhöhung um 1 K zu erreichen.
Die spezifische Wärmekapazität ist ein Stoffwert und gibt an, wieviel Energie in kJ einem kg des betrachteten Stoffs (hier Eis) zugeführt werden muss, um eine Temperaturerhöhung um 1 K zu erreichen.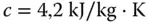 aufweist. Dadurch kann Wasser sehr viel Wärme aufnehmen, ohne sich merklich zu erwärmen.
aufweist. Dadurch kann Wasser sehr viel Wärme aufnehmen, ohne sich merklich zu erwärmen. Bedingt durch seine hohe Wärmekapazität eignet sich Wasser sehr gut als Kühlmittel in Wärmeaustauschern. Morgens beim Frühstück haben Sie dafür das Problem, das Sie dem Wasser sehr viel Energie zuführen müssen, damit es kocht und Sie Ihren Tee oder Kaffee aufbrühen können. Schalten Sie Ihren Wasserkocher ein und beobachten Sie Ihren Stromzähler! Sie werden sehen, wie schnell der sich dann dreht.
Bedingt durch seine hohe Wärmekapazität eignet sich Wasser sehr gut als Kühlmittel in Wärmeaustauschern. Morgens beim Frühstück haben Sie dafür das Problem, das Sie dem Wasser sehr viel Energie zuführen müssen, damit es kocht und Sie Ihren Tee oder Kaffee aufbrühen können. Schalten Sie Ihren Wasserkocher ein und beobachten Sie Ihren Stromzähler! Sie werden sehen, wie schnell der sich dann dreht.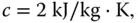 diese liegt also in einer ähnlichen Größenordnung wie beim Eis.
diese liegt also in einer ähnlichen Größenordnung wie beim Eis.










