Ist das Wasser salzgesättigt, liegt der Siedepunkt bei 108 °C. Das werden Sie Ihren Geschmacksnerven aber auch kaum zumuten wollen.
Gefrierpunktserniedrigung
Die Zugabe von Salz zu Wasser hat noch weitere Auswirkungen: die Wassermoleküle werden auch daran gehindert, bei 0 °C Eiskristalle zu bilden. Die Salzlösung gefriert erst bei wesentlich niedrigeren Temperaturen. Daher wird im Winter Salz gestreut, um die Straßen und Gehwege von Eis und Schnee zu befreien. Das Streusalz spaltet sich in positiv geladene Natrium (Na +)- und negativ geladene Chloridionen (Cl –) auf. Um die Chloridionen zu binden, docken die Wassermoleküle mit ihrer positiv geladenen Seite (H +) hieran an. Die Natriumionen (Na +) werden von den negativen Sauerstoffionen des Wassers (O 2–) gebunden. Dieser Vorgang bewirkt, dass die Natrium- und Chloridionen kontinuierlich Wassermoleküle aus dem Eiskristall herauslösen. So wird die Kristallbildung gestört, das Eis taut und es entsteht eine Salzlösung, der Gefrierpunkt des Wassers sinkt.
 Eine gesättigte Kochsalzlösung hat einen Gefrierpunkt von –21,3 °C. Bei niedrigeren Temperaturen (die in Mitteleuropa allerdings sehr selten auftreten), wird kein Salz mehr gestreut, es wäre schlichtweg wirkungslos. Sollten im Winter wieder einmal Temperaturen unter –22 °C auftreten, können Sie guten Gewissens das Streusalz im Haus lassen und sich vor den warmen Ofen setzen.
Eine gesättigte Kochsalzlösung hat einen Gefrierpunkt von –21,3 °C. Bei niedrigeren Temperaturen (die in Mitteleuropa allerdings sehr selten auftreten), wird kein Salz mehr gestreut, es wäre schlichtweg wirkungslos. Sollten im Winter wieder einmal Temperaturen unter –22 °C auftreten, können Sie guten Gewissens das Streusalz im Haus lassen und sich vor den warmen Ofen setzen.
 Die Dampfdruckkurve zeigt in grafischer Darstellung die Abhängigkeit des Dampfdrucks eines reinen Stoffs von der Temperatur. Sie beginnt am Schmelzpunkt und endet am kritischen Punkt.
Die Dampfdruckkurve zeigt in grafischer Darstellung die Abhängigkeit des Dampfdrucks eines reinen Stoffs von der Temperatur. Sie beginnt am Schmelzpunkt und endet am kritischen Punkt.
Sie haben bemerkt, dass der Phasenübergang flüssig zu gasförmig in der Technik von besonderer Bedeutung ist. Daher ist es sinnvoll, diesen Phasenübergang möglichst einfach darzustellen. Hierzu dient die Dampfdruckkurve.
Darstellung der Dampfdruckkurve
Die Dampfdruckkurve wird normalerweise in einem Druck-Temperatur-Diagramm aufgetragen, wie Sie dies in Abbildung 2.19sehen. Werden beide Achsen logarithmisch unterteilt, wird die Dampfdruckkurve zu einer Geraden. Auf der Dampfdruckkurve liegen die Siedepunkte der betrachteten Flüssigkeit. Die Siedetemperatur ist vom verdampfenden Stoff abhängig. Sie erkennen, dass Alkohol (Ethanol, C 2H 5OH) bei einem festgelegten Druck früher siedet als Wasser, Tetrachlorethan (C 2H 2Cl 4) hat einen höheren Siedepunkt.
Der Übergang von der flüssigen zur gasförmigen Phase erfolgt am Siedepunkt. Da eine Flüssigkeit siedet, wenn ihr Dampfdruck gleich dem vorherrschenden Umgebungsdruck ist, ist die Siedetemperatur vom Druck abhängig, wie Abbildung 2.19verdeutlicht. Je höher der Druck ist, desto höher ist auch der Siedepunkt. Wenn Sie den Druck erniedrigen, beginnt eine Flüssigkeit früher zu sieden.
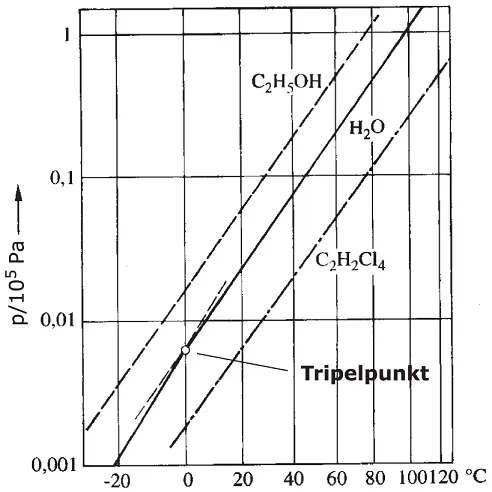
Abbildung 2.19Dampfdruckkurven von Wasser, Ethylalkohol (C 2H 5OH) und Tetrachlorethan (C 2H 2Cl 4)
 Wenn Sie von der Nordsee aus auf den höchsten Berg der Erde (Mt. Everest, 8848 m) steigen, beginnt Ihr Wasser bei immer geringeren Temperaturen zu sieden. Der Luftdruck in der Höhe des Mt. Everest beträgt 0,325 · 10 5Pa, also nur noch 32,1 % des Atmosphärendrucks an der Nordsee. Ihr Wasser siedet daher bereits bei 71 °C. Ob das allerdings die Mühe wert ist auf den Mt. Everest zu steigen (ganz zu schweigen von der fußläufigen Anreise), müssen Sie selbst entscheiden.
Wenn Sie von der Nordsee aus auf den höchsten Berg der Erde (Mt. Everest, 8848 m) steigen, beginnt Ihr Wasser bei immer geringeren Temperaturen zu sieden. Der Luftdruck in der Höhe des Mt. Everest beträgt 0,325 · 10 5Pa, also nur noch 32,1 % des Atmosphärendrucks an der Nordsee. Ihr Wasser siedet daher bereits bei 71 °C. Ob das allerdings die Mühe wert ist auf den Mt. Everest zu steigen (ganz zu schweigen von der fußläufigen Anreise), müssen Sie selbst entscheiden.
 Da Ihr Wasser bereits bei 71 °C siedet, müssen Sie Ihre Eier auch bei dieser Temperatur hartkochen, was wesentlich länger dauert. Sie sehen, Ihr Frühstück wird nicht schneller fertig.
Da Ihr Wasser bereits bei 71 °C siedet, müssen Sie Ihre Eier auch bei dieser Temperatur hartkochen, was wesentlich länger dauert. Sie sehen, Ihr Frühstück wird nicht schneller fertig.
Auf dem Mt. Everest haben Sie das Gegenteil eines Schnellkochtopfs, in dem ja bei hohem Druck gearbeitet wird, damit die Siedetemperatur steigt und Ihre Kartoffeln in wesentlich kürzerer Zeit gar sind als bei Umgebungsdruck!
 Für Wasser gilt:
Für Wasser gilt: 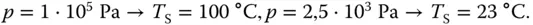
Beginnen wir mit einer Definition:
 Der Druck, der durch Verdampfen beziehungsweise Verdunsten einer Flüssigkeit entsteht, wird als Dampfdruck bezeichnet.
Der Druck, der durch Verdampfen beziehungsweise Verdunsten einer Flüssigkeit entsteht, wird als Dampfdruck bezeichnet.
Der Dampfdruck hängt vom verdampfenden Stoff sowie der Temperatur ab. Abbildung 2.20zeigt die Zusammenhänge. Ein Behälter mit Flüssigkeit ist bei tiefer Temperatur ( T 1) von einem beweglichen Kolben verschlossen. Es existiert keine Dampfphase, der Dampfdruck ( p 0) ist null. Wird die Flüssigkeit durch Energiezufuhr auf die höhere Temperatur T 2erwärmt, bildet sich über der flüssigen Phase auch eine Dampfphase aus, da einige Moleküle durch die Energiezufuhr eine ausreichend hohe kinetische Energie besitzen, um die intermolekularen Anziehungskräfte in der Flüssigkeit zu überwinden und in die Gasphase überzugehen. Die freigesetzten Moleküle üben einen Druck auf die Gefäßwände aus. Der entstandene Dampfdruck kann gemessen werden. Durch weitere Wärmezufuhr verdampft immer mehr Flüssigkeit, der Flüssigkeitsanteil wird dadurch immer geringer, der Dampfanteil und damit der Dampfdruck steigt an.
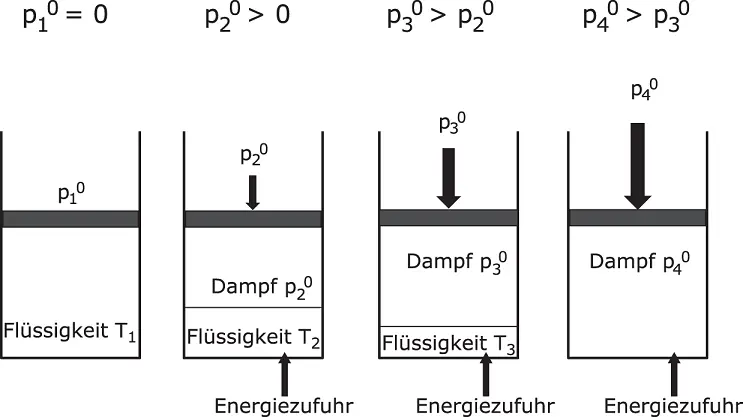
Abbildung 2.20Dampfdruck
Der Dampfdruck für eine Komponente i 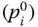 lässt sich sehr gut mit der von Antoine vorgeschlagenen Korrelationsbeziehung
lässt sich sehr gut mit der von Antoine vorgeschlagenen Korrelationsbeziehung
(2.21) 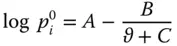
beschreiben. A , B und C sind stoffabhängige Konstanten. In Formel 2.21müssen Sie den Druck 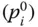 in bar, die Temperatur ϑ in °C angeben.
in bar, die Temperatur ϑ in °C angeben.
 Für Benzol gilt:
Für Benzol gilt: 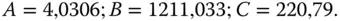 Zu ermitteln ist der Dampfdruck bei den Temperaturen 6 °C, 20 °C sowie 125 °C! Die Antoine-Gleichung lautet damit für Benzol:
Zu ermitteln ist der Dampfdruck bei den Temperaturen 6 °C, 20 °C sowie 125 °C! Die Antoine-Gleichung lautet damit für Benzol:
Читать дальше

 Eine gesättigte Kochsalzlösung hat einen Gefrierpunkt von –21,3 °C. Bei niedrigeren Temperaturen (die in Mitteleuropa allerdings sehr selten auftreten), wird kein Salz mehr gestreut, es wäre schlichtweg wirkungslos. Sollten im Winter wieder einmal Temperaturen unter –22 °C auftreten, können Sie guten Gewissens das Streusalz im Haus lassen und sich vor den warmen Ofen setzen.
Eine gesättigte Kochsalzlösung hat einen Gefrierpunkt von –21,3 °C. Bei niedrigeren Temperaturen (die in Mitteleuropa allerdings sehr selten auftreten), wird kein Salz mehr gestreut, es wäre schlichtweg wirkungslos. Sollten im Winter wieder einmal Temperaturen unter –22 °C auftreten, können Sie guten Gewissens das Streusalz im Haus lassen und sich vor den warmen Ofen setzen. Die Dampfdruckkurve zeigt in grafischer Darstellung die Abhängigkeit des Dampfdrucks eines reinen Stoffs von der Temperatur. Sie beginnt am Schmelzpunkt und endet am kritischen Punkt.
Die Dampfdruckkurve zeigt in grafischer Darstellung die Abhängigkeit des Dampfdrucks eines reinen Stoffs von der Temperatur. Sie beginnt am Schmelzpunkt und endet am kritischen Punkt.
 Wenn Sie von der Nordsee aus auf den höchsten Berg der Erde (Mt. Everest, 8848 m) steigen, beginnt Ihr Wasser bei immer geringeren Temperaturen zu sieden. Der Luftdruck in der Höhe des Mt. Everest beträgt 0,325 · 10 5Pa, also nur noch 32,1 % des Atmosphärendrucks an der Nordsee. Ihr Wasser siedet daher bereits bei 71 °C. Ob das allerdings die Mühe wert ist auf den Mt. Everest zu steigen (ganz zu schweigen von der fußläufigen Anreise), müssen Sie selbst entscheiden.
Wenn Sie von der Nordsee aus auf den höchsten Berg der Erde (Mt. Everest, 8848 m) steigen, beginnt Ihr Wasser bei immer geringeren Temperaturen zu sieden. Der Luftdruck in der Höhe des Mt. Everest beträgt 0,325 · 10 5Pa, also nur noch 32,1 % des Atmosphärendrucks an der Nordsee. Ihr Wasser siedet daher bereits bei 71 °C. Ob das allerdings die Mühe wert ist auf den Mt. Everest zu steigen (ganz zu schweigen von der fußläufigen Anreise), müssen Sie selbst entscheiden. Da Ihr Wasser bereits bei 71 °C siedet, müssen Sie Ihre Eier auch bei dieser Temperatur hartkochen, was wesentlich länger dauert. Sie sehen, Ihr Frühstück wird nicht schneller fertig.
Da Ihr Wasser bereits bei 71 °C siedet, müssen Sie Ihre Eier auch bei dieser Temperatur hartkochen, was wesentlich länger dauert. Sie sehen, Ihr Frühstück wird nicht schneller fertig.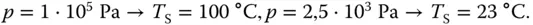

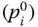 lässt sich sehr gut mit der von Antoine vorgeschlagenen Korrelationsbeziehung
lässt sich sehr gut mit der von Antoine vorgeschlagenen Korrelationsbeziehung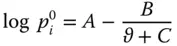
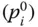 in bar, die Temperatur ϑ in °C angeben.
in bar, die Temperatur ϑ in °C angeben.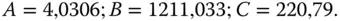 Zu ermitteln ist der Dampfdruck bei den Temperaturen 6 °C, 20 °C sowie 125 °C! Die Antoine-Gleichung lautet damit für Benzol:
Zu ermitteln ist der Dampfdruck bei den Temperaturen 6 °C, 20 °C sowie 125 °C! Die Antoine-Gleichung lautet damit für Benzol:










