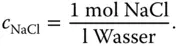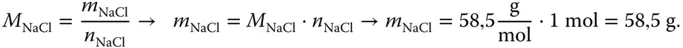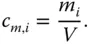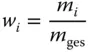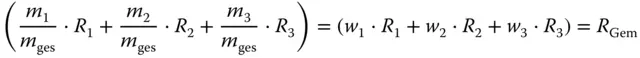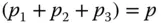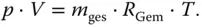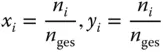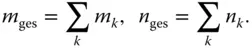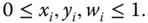In der Praxis werden unterschiedliche Möglichkeiten verwendet, um Konzentrationen anzugeben. Die für die Verfahrenstechnik wichtigen werden Sie jetzt kennenlernen.
Wie konzentriert soll's denn sein?
In der Verfahrenstechnik und der Chemie sind verschiedene Möglichkeiten gebräuchlich, um eine Konzentration anzugeben, die alle ihre Vor- und Nachteile besitzen.
Die molare Konzentration c imit der Einheit mol/m 3(sehr häufig auch angegeben als mol/l) ist der Quotient aus der Stoffmenge n iund dem Volumen V :
(3.1) 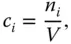
wobei der Index i die Komponente angibt, für die das Konzentrationsmaß ermittelt werden soll.
 Bei der Entschwefelung gemäß obigem Beispiel wird das Konzentrationsmaß immer für die übergehende Komponente, das Schwefeldioxid, angegeben, da nur dieses zwischen den beiden Phasen ausgetauscht wird ( i ≡ Schwefeldioxid).
Bei der Entschwefelung gemäß obigem Beispiel wird das Konzentrationsmaß immer für die übergehende Komponente, das Schwefeldioxid, angegeben, da nur dieses zwischen den beiden Phasen ausgetauscht wird ( i ≡ Schwefeldioxid).
 Sie wollen eine einmolare Kochsalzlösung herstellen. Das bedeutet, dass Sie ein Mol Kochsalz (NaCl) pro Liter Wasser benötigen:
Sie wollen eine einmolare Kochsalzlösung herstellen. Das bedeutet, dass Sie ein Mol Kochsalz (NaCl) pro Liter Wasser benötigen:
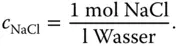
Nun wissen Sie aus dem vorigen Kapitel, das das mit dem Mol so ein Problem ist. Wie bekommen Sie ein Mol Kochsalz in ein Liter Wasser? Es bleibt Ihnen nichts Anderes übrig, als das Kochsalz zu wiegen. Sie müssen genau so viel Gramm einwiegen, dass diese Masse einem Mol entspricht! Jetzt erinnern Sie sich wieder an das letzte Kapitel und wissen, wie die Molmasse M definiert ist:
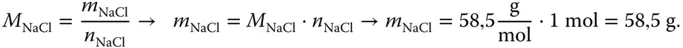
Wenn Sie also 58,5 g Kochsalz in 1 l Wasser geben, erhalten Sie eine einmolare Kochsalzlösung.
Selbstverständlich kann auch mit der Massenkonzentration c m,i, Einheit kg/m 3, gearbeitet werden. Hier wird die Masse des Stoffs i ( m i) auf das Volumen bezogen:
(3.2) 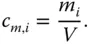
Neben den bisher besprochenen Konzentrationen besteht die Möglichkeit, den Anteil einer Komponente an der Gesamtmenge anzugeben. Die Konzentrationsangabe ist dann dimensionslos. In der Verfahrenstechnik werden dazu verwendet
Massenanteil,
Stoffmengenanteil und
Volumenanteil.
Abbildung 3.2zeigt drei Behälter mit dem gleichen Volumen V . In ihnen befinden sich drei Gase mit der gleichen Temperatur T , aber unterschiedlichen Drücken und Massen. Diese drei Gase werden in den rechten Behälter 4 mit dem gleichen Volumen V gefördert, sodass sich im Behälter 4 der neue Druck p und die neue Masse m einstellen.
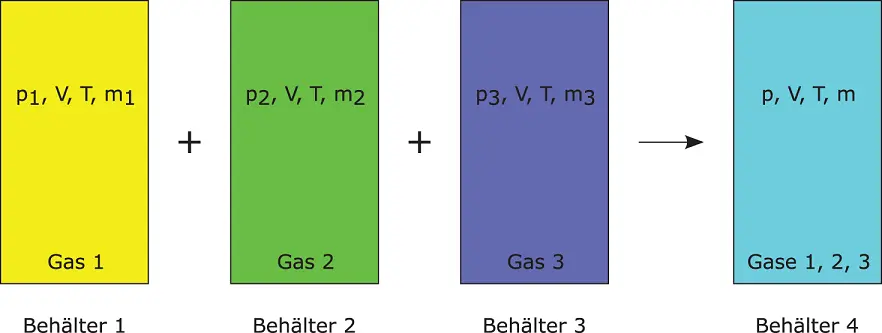
Abbildung 3.2Massenanteil
Es gilt das ideale Gasgesetz
für Behälter 1,
für Behälter 2 und
für Behälter 3.
Für Behälter 4 ergibt sich dann
beziehungsweise
Das Verhältnis m i/ m geswird als Massenanteil oder Massenbruch bezeichnet. Beim Massenanteil
(3.3) 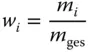
wird die Masse m ider betrachteten Komponente i auf die Gesamtmasse des Gemischs m gesbezogen.
Der Klammerausdruck
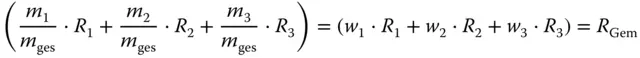
entspricht der mittleren spezifischen Gaskonstante der Gasmischung R Gem. Der Gesamtdruck p ist die Summe der Einzeldrücke
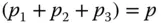
und somit
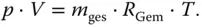
In ähnlicher Weise wie beim Massenanteil wird beim Stoffmengenanteil (auch Molanteil genannt)
(3.4) 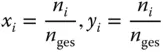
die Stoffmenge der Komponente i , n i, auf die Gesamtstoffmenge n gesbezogen. Jetzt sehen Sie etwas ganz Seltsames, was Sie eigentlich vermeiden sollten: für den Stoffmengenanteil werden zwei Bezeichnungen x und y verwendet, die genau das gleiche aussagen. Dies macht hier aber Sinn, denn der Stoffmengenanteil x beschreibt die Zusammensetzung der schweren Phase, y dagegen die Zusammensetzung der leichten Phase. Die Bezeichnungen x und y beziehen sich hier also auf unterschiedliche Phasen!
 In Abbildung 3.1ist die Flüssigkeit die schwere Phase (Stoffmengenanteil x ) und die Gasphase die leichte Phase (Stoffmengenanteil y ). Für den Stoffmengenanteil des Schwefeldioxids in der leichten Gasphase erhalten Sie somit
In Abbildung 3.1ist die Flüssigkeit die schwere Phase (Stoffmengenanteil x ) und die Gasphase die leichte Phase (Stoffmengenanteil y ). Für den Stoffmengenanteil des Schwefeldioxids in der leichten Gasphase erhalten Sie somit

Da sich die Gesamtmasse m gesbeziehungsweise die Gesamtmolmasse n gesaus den Einzelmassen m ibeziehungsweise Einzelmolmassen n ider k in der Mischphase vorliegenden Komponenten zusammensetzt, gilt
(3.5) 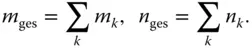
Somit müssen die Massen- und Stoffmengenanteile zwischen den Grenzen 0 und 1 laufen:
(3.6) 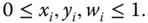
 Für das Beispiel aus Abbildung 3.1bedeutet das:
Für das Beispiel aus Abbildung 3.1bedeutet das:
: kein Schwefeldioxid im Gas,
: das Gas besteht nur aus Schwefeldioxid.
Als weiteres Konzentrationsmaß können Sie die Beladung einführen.
Читать дальше

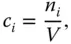
 Bei der Entschwefelung gemäß obigem Beispiel wird das Konzentrationsmaß immer für die übergehende Komponente, das Schwefeldioxid, angegeben, da nur dieses zwischen den beiden Phasen ausgetauscht wird ( i ≡ Schwefeldioxid).
Bei der Entschwefelung gemäß obigem Beispiel wird das Konzentrationsmaß immer für die übergehende Komponente, das Schwefeldioxid, angegeben, da nur dieses zwischen den beiden Phasen ausgetauscht wird ( i ≡ Schwefeldioxid).