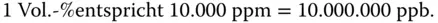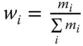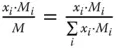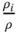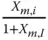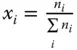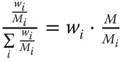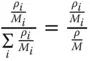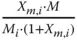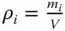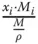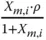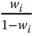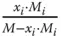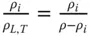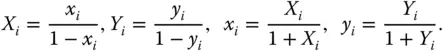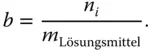was häufig für Umrechnungen genutzt wird.
Volumenanteile werden in der Praxis sehr häufig als Konzentrationsmaße verwendet. Der Grund ist, dass der Mensch sich Volumenanteile leichter vorstellen kann als Massenanteile, von Molanteilen ganz zu schweigen. Werden Gasmischungen analysiert, wird der Anteil der Einzelgase normalerweise in Volumenprozent angegeben.
Wenn der Kaminkehrer an Ihrer Heizungsanlage eine Abgasmessung durchführt, darf der CO-Gehalt einen Grenzwert von 1000 ppm (0,1 Vol.-%) nicht überschreiten.
Der Anteil von Sauerstoff in der Luft beträgt 21 Volumenprozent und somit = 0,21.
Häufig müssen Sie sehr kleine Konzentrationen angeben. Als Verfahrenstechniker passiert Ihnen das beispielsweise bei der Angabe von Schadstoffkonzentrationen in der Luft oder im Wasser. Hier wird die Dimension ppm oder ppb gewählt. Es bedeutet
ppm ≡ parts per million ≡
ppb ≡ parts per billion ≡
Um dieses Konzentrationsmaß etwas zu verdeutlichen:
»ppm« bedeutet, dass sich ein Teilchen der betrachteten Substanz in einer Million Teilchen der Umgebung befinden, bei »ppb« befindet sich dementsprechend ein Teil der betrachteten Substanz in einer Milliarde anderer Teilchen. Das ist jeweils nicht viel!
 Dies soll ein kleines Beispiel belegen:
Dies soll ein kleines Beispiel belegen:
1 ppm bedeutet, dass auf einer Strecke von 1000 m eine Längenänderung von 1 mm auftritt, oder dass ein Stück Würfelzucker in einem Tanklastzug gelöst ist!
1 ppb ist dementsprechend noch viel weniger. Bei einer Weltbevölkerung im Jahr 2019 von 7,7 Milliarden Menschen entspricht dies 7,7 Personen auf der gesamten Erde. Dies ist fast nichts! Und jetzt überlegen Sie sich einmal, wie Sie Schadstoffe im ppb-Bereich messen wollen! Bei Dioxinen ist dies genau die Fragestellung.

 Der Alkoholgehalt wird immer in Volumenprozent angegeben. Ein halber Liter Bier mit 5 Vol.-% Alkohol enthält somit 0,025 l reinen Alkohol, also ein gutes Schnapsglas voll. Trinken Sie dagegen einen Schnaps (Schnapsglas mit 0,02 l) mit 38 Vol.-% Alkohol, haben Sie 7,6·10 –3l Alkohol zu sich genommen. Mit 4 Gläsern Schnaps haben Sie dann 0,03 l reinen Alkohol getrunken und damit etwas mehr als der Biertrinker. Trinken Sie beides zusammen, hat dies dann häufig schon fatale Folgen!
Der Alkoholgehalt wird immer in Volumenprozent angegeben. Ein halber Liter Bier mit 5 Vol.-% Alkohol enthält somit 0,025 l reinen Alkohol, also ein gutes Schnapsglas voll. Trinken Sie dagegen einen Schnaps (Schnapsglas mit 0,02 l) mit 38 Vol.-% Alkohol, haben Sie 7,6·10 –3l Alkohol zu sich genommen. Mit 4 Gläsern Schnaps haben Sie dann 0,03 l reinen Alkohol getrunken und damit etwas mehr als der Biertrinker. Trinken Sie beides zusammen, hat dies dann häufig schon fatale Folgen!
 Wo Sie gerade beim Alkohol sind, können Sie sich hier gleich noch ein Beispiel anschauen. Der getrunkene Alkohol wird im Blut gelöst, Sie haben nach dem Alkoholgenuss eine bestimmte Blutalkoholkonzentration. Die Blutalkoholkonzentration (BAK) gibt die im Blut enthaltene Menge an Alkohol an. Sie wird in Gramm Reinalkohol pro Kilogramm Blut als »Promille (‰)« angegeben. Eine BAK von 1‰ bedeutet, dass 1 Kilogramm Blut 1 Gramm reinen Alkohol enthält. Das sind 1000 ppm. Sie sehen, dass Sie die Einheit ppm beziehungsweise ppb sowohl als Volumen- als auch als Massenanteile angeben können.
Wo Sie gerade beim Alkohol sind, können Sie sich hier gleich noch ein Beispiel anschauen. Der getrunkene Alkohol wird im Blut gelöst, Sie haben nach dem Alkoholgenuss eine bestimmte Blutalkoholkonzentration. Die Blutalkoholkonzentration (BAK) gibt die im Blut enthaltene Menge an Alkohol an. Sie wird in Gramm Reinalkohol pro Kilogramm Blut als »Promille (‰)« angegeben. Eine BAK von 1‰ bedeutet, dass 1 Kilogramm Blut 1 Gramm reinen Alkohol enthält. Das sind 1000 ppm. Sie sehen, dass Sie die Einheit ppm beziehungsweise ppb sowohl als Volumen- als auch als Massenanteile angeben können.
Tabelle 3.1zeigt wichtige Umrechnungsbeziehungen zwischen den Konzentrationsmaßen.
|
Massenanteil w i |
Stoffmengenanteil x i |
Partialdichte ρ i |
Massenbeladung X m,i |
Massenanteil 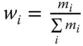 |
w i |
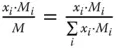 |
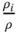 |
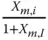 |
Stoffmengenanteil 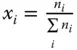 |
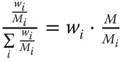 |
x i |
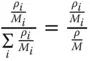 |
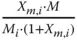 |
Partialdichte 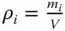 |
w i⋅ ρ |
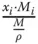 |
ρ i |
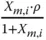 |
Massenbeladung  |
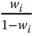 |
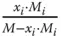 |
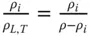 |
X m,i |
Tabelle 3.1 Umrechnungsbeziehungen
Stoffmengenbeladung und Stoffmengenanteil können einfach ineinander umgerechnet werden:
(3.20) 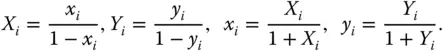
Zum Abschluss noch ein Konzentrationsmaß, das eigentlich nur von den Chemikern benutzt wird. Da wir Verfahrenstechniker es aber häufig auch mit Chemikern zu tun haben, ist es nicht schlecht, wenn auch Sie den Begriff der Molalität kennen. Chemiker geben die Molalität b in mol/kg oder häufiger mol/l an. Die Molalität gibt die Stoffmenge n ides gelösten Stoffs i in der Masse eines Lösungsmittels m Lösungsmittelan, oder mit anderen Worten: wieviel Mol eines Stoffs i sind in 1 Liter Lösung enthalten:
(3.21) 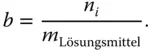
Читать дальше

 Dies soll ein kleines Beispiel belegen:
Dies soll ein kleines Beispiel belegen: