Der intrazelluläre pH-Wert ist Voraussetzung für wichtige zelluläre Vorgänge wie Mitose, Proteinbiosynthese und Glykolyse und aktiviert die Calcium-Calmodulin-Signalwege. Eine Veränderung des pH-Wertes kann somit zu bedeutenden Effekten im Zellmetabolismus führen.
In Krebszellen ist die Aktivität der Natrium-Protonen-Antiporter gesteigert (Miraglia et al. , 2005). So gleichen diese ihre intrazelluläre Milchsäure-Azidose aus, erreichen eine Chemotherapieresistenz und erhöhen den intrazellulären pH-Wert, der für ihr Wachstum essentiell ist.
Aktivität der Natrium-Protonen- und der Natrium-Kalium-Pumpe bei Krebskranken
Borg et al. (1996) konnten zeigen, dass auch bei den Erythrozyten von Krebskranken die Funktionen der Natrium-Kalium-Pumpe und des Natrium-Protonen-Antiporters gestört sind. Dies ist ein Phänomen, das Dunkelfeld-Diagnostikern schon seit Jahrzehnten bekannt ist. Während die Natrium-Kalium-Pumpe deutlich schlechter arbeitete, war die Aktivität des Natrium-Protonen-Antiporters bei Krebskranken im Vergleich zu gesunden Personen im Schnitt um 83 % erhöht. Bei einer Remission normalisierten sich die Aktivitäten beider Pumpen. Dass bei einem vorliegenden Krebsleiden die Natrium-Transporter der Erythrozyten beeinflusst werden, obwohl diese in keinem offensichtlichen Zusammenhang zum Krebsgewebe stehen, liegt an Faktoren im Blutplasma (Kovacic et al. , 1998).
Die nachfolgende Abbildung (Abb. 9) beschreibt den Einfluss veränderter Zellpumpenaktivitäten auf die intrazellulären Mineralstoffspiegel und die daraus entstehenden Folgen, u. a. auf Krebsentstehung und Krebswachstum, die im Folgenden noch thematisiert werden.
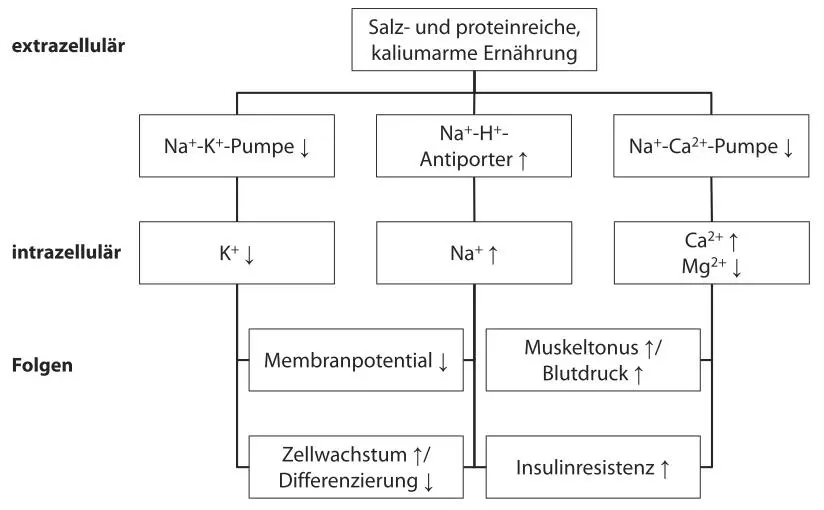
Abb. 9: Einfluss der verschiedenen Pumpen auf die intrazellulären Mineralstoffspiegel und Folgen
3.8.3 Natrium-Einlagerung ins Bindegewebe fördert Krebsmetastasen
Neueren Erkenntnissen zufolge spielt Natrium noch in einem weiteren Zusammenhang eine wichtige Rolle bei der Krebsentstehung. Eine Arbeitsgruppe entdeckte, dass sich überschüssiges Natrium in das Bindegewebe einlagern kann.
Dies geschieht durch Bindung an polyanionische Matrixmoleküle (Glykosaminoglykane) im Zwischenzellgewebe (Schafflhuber et al. , 2007). Durch diese Natriumansammlung im Bindegewebe entsteht osmotischer Stress, der im Unterhautgewebe zur Sekretion von VEGF-C ( Vascular Endothelial Growth Factor C ) führt (Titze und Machnik, 2010). In einer Studie resultierte die erhöhte Zufuhr von Natrium in Form von Kochsalz in einem Anstieg von VEGF-C bei Patienten mit chronischer Nierenerkrankung. Derselbe Trend war in gesunden Personen zu beobachten (Slagman et al. , 2012). Auch in einer weiteren Studie konnte dieser Effekt beobachtet werden. Dabei war die Sekretion von VEGF-C bei einer salzreichen Ernährung höher als bei einer salzarmen Ernährung (Liu et al. , 2011).
VEGF-C ist ein Wachstumsfaktor, der u. a. die vermehrte Bildung von Lymphgefäßen fördert (Titze und Machnik, 2010). Die Bildung von Lymphgefäßen im Tumorgewebe ist ein kritischer Faktor bei dessen Entartung und führt zur Streuung des Tumors. Skobe et al. (2001) stellten in einer Studie fest, dass VEGF-C für die vermehrte Bildung von Lymphgefäßen in Tumorgeweben verantwortlich ist, was zu einer verstärkten Ausbildung von Metastasen führt. Auch in einer Studie an humanen Pankreasadenokarzinomen konnte ermittelt werden, dass VEGF-C in denjenigen Proben erhöht war, in denen sich Lymphknoten-Metastasen gebildet hatten (Guo et al. , 2013). Eine verstärkte Bildung von Lymphgefäßen könnte als Marker für eine spätere Bildung von Metastasen dienen (Tobler und Detmar, 2006).
Chemokine können dazu beitragen, dass Tumorzellen und Lymphgefäße zueinander finden. Faktoren wie VEGF-C können die Bildung von Lymphgefäßen in Lymphknoten anregen, noch bevor Tumorzellen dort angekommen sind (Achen und Stacker, 2008).
Wie bereits beschrieben, ist das Milieu im Gewebe entscheidend dafür, ob Krebszellen proliferieren oder nicht. Durch eine zu hohe Salzzufuhr und die folglich erhöhte Sekretion von VEGF-C wird also offenbar ein Milieu geschaffen, das es Krebszellen erleichtert Metastasen zu bilden.
Wenn Ärzte die Nährstoffversorgung von Patienten untersuchen, verlassen sie sich üblicherweise auf die Serumwerte. Dass das lymphatische System auch eine sehr wichtige Rolle spielt, wird dabei leider außer Acht gelassen. Die aufgeführten Studien zeigen zudem, dass eine genaue Bestimmung des Elektrolythaushalts scheinbar noch schwieriger ist als bisher angenommen, da das Zwischenzellgewebe nur sehr schwer daraufhin untersucht werden kann.
Klinisch und optisch zeigt sich eine Natriumchlorid-Einlagerung an der vermehrten Bildung von Lymphödemen (Wassereinlagerung im Bindegewebe). Starke Salzreduktion und kaliumreiche Ernährung sind eine ursächliche Therapie. Ödeme (z. B. Lid- und Gesichtsödeme) treten auch verstärkt unter Stress und damit verbundener Aldosteron-Ausschüttung auf und weisen auch auf einen erschöpften Energie- sowie gestörten Elektrolythaushalt hin.
3.8.4 Reduktion des Membranpotentials fördert die Krebsentstehung
Das Membranpotential ist eine wichtige nicht-genetische, biophysikalische Eigenschaft des Tumormilieus ( microenvironment ), welche die Balance zwischen normalem Wachstum und Krebsentstehung reguliert. Bereits vor langer Zeit wurde ein Zusammenhang zwischen den bioelektrischen Eigenschaften eines Gewebes und der Entwicklung von Krebs vermutet (Burr et al. , 1938; Burr, 1940). Clarence D. Cone Jr. unternahm in den 1960er Jahren eine Reihe bahnbrechender Experimente und entdeckte als Erster, dass sich das Membranpotential im Verlauf des Zellzyklus verändert. Er postulierte daraufhin, dass die Abweichungen in proliferierenden Zellen mit dem Fortschreiten des Zellzyklus von der G1- in die S-Phase und von der G2- in die M-Phase verbunden waren. In reifen Neuronen des zentralen Nervensystems wird durch eine verlängerte Depolarisierung der Zellmembran die Synthese von DNA ausgelöst und die Zellen treten erneut in die Mitose ein (Cone, 1971; Cone und Tongier, 1971). Außerdem wird auf diese Weise eine Überproliferation von Fibroblasten verursacht (Sundelacruz et al. , 2008). Cone formulierte auf Basis dieser Beobachtungen seine Theorie über die Kontrolle von Mitose und Onkogenese (Cone, 1971).
Bekanntlich sind die meisten Krebsarten epithelialen Ursprungs, sie gehen also von Zellen aus, die ein konstantes Ruhepotential haben und keine Aktionspotentiale bilden wie Nerven- oder Muskelzellen. Durch das Ruhepotential nicht-erregbarer Zellen werden zelluläre Eigenschaften wie Proliferation, Migration und Form reguliert (Blackiston et al. , 2009; Sundelacruz et al. , 2009). Zudem wird durch endogene bioelektrische Signale gewährleistet, dass Vorgänge wie Regeneration (Levin, 2007 und 2009), Entwicklung (Adams, 2008; Levin, 2012a) und Wundheilung (Nuccitelli, 2003; McCaig et al. , 2005 und 2009) koordiniert ablaufen. All dies sind Hinweise darauf, dass es sich bei Krebs um eine Entwicklungsstörung handelt, bei der Ionenflüsse und die sich daraus ergebenden Spannungsgradienten eine wichtige Rolle spielen. Diese beiden Parameter machen es möglich, das neoplastische Verhalten von Zellen vorherzusagen und zu kontrollieren (Huang et al. , 2009; Levin, 2012b; Rubin, 1985).
Die proliferativen Fähigkeiten einer Zelle stehen mit der jeweiligen Membranspannung im Zusammenhang: Ruhende Zellen sind normalerweise hyperpolarisiert, stark proliferierende Zellen wie Embryonalzellen, Stammzellen und Krebszellen sind depolarisiert (Binggeli und Weinstein, 1986; Levin, 2007). Das Membranpotential ist dabei kein Korrelat, sondern ein ursächlicher Faktor in der Kontrolle von Wachstum oder Zelldifferenzierung.
Читать дальше













