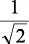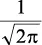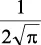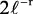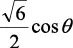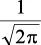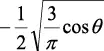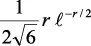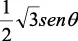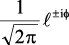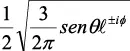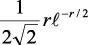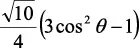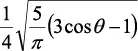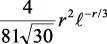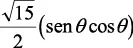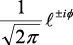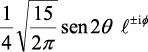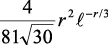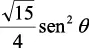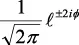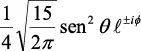l = 0, 1, 2, 3, ..., (n – 1).
l es denominado el número cuántico orbital o azimutal, y determina el momento angular del electrón.
El momento angular es una cantidad vectorial. l da su magnitud, pero su dirección está determinada por m. En otras palabras, m caracteriza la posición del orbital en el espacio. m toma valores enteros entre +1 y –1, incluyendo cero.
Cada combinación diferente de n, l y m corresponde a un único estado cuántico orbital.
Sin embargo, los números cuánticos n, l y m, en la solución de la ecuación de Schrödinger, no describen completamente el movimiento de los electrones en los átomos. El estudio de los espectros y otras investigaciones han demostrado que hay una característica adicional que surge de un cuarto grado de libertad, el llamado espín electrónico, o sea la rotación sobre su propio eje.
El espín o autorrotación del electrón se debe a su movimiento angular inherente y es tan fundamental como su carga o su masa. El número cuántico s tiene dos valores: +1/2 y –1/2, pues el electrón sólo puede girar en dos direcciones diferentes.
Los cuatro números cuánticos n, l, m y s describen completamente el movimiento del electrón en el átomo.
Las siguientes designaciones se usan para representar el estado electrónico en los átomos; el número cuántico n se designa con números, y el l, con letras, así:
| l |
0 |
1 |
2 |
3 |
4 |
5 |
| designación |
s |
p |
d |
f |
g |
h |
Las primeras letras provienen de la espectroscopia, donde las series espectrales se deben a la transición de electrones, correspondientes a valores definidos del número cuántico l (sharp, principal, diffuse, fundamental); las últimas dos letras son las que siguen en el alfabeto a f.
El estado de los electrones en átomos polielectrónicos siempre satisface el principio de exclusión de Pauli, el cual establece que en un átomo o molécula, dos electrones dados no pueden tener los mismos cuatro números cuánticos. Esto restringe el número de electrones que en un átomo pueden tener un valor dado de n.
Si n = l, l y m solo pueden valer cero. Por consiguiente, los electrones con n = l solo pueden diferir en su espín; así que en un átomo únicamente puede haber dos electrones con número cuántico principal n = l.
|
n |
m |
l |
s |
| primer electrón |
1 |
0 |
0 |
+1/2 |
| segundo electrón |
1 |
0 |
0 |
–1/2 |
La denominación 1s2 indica que en un átomo hay dos electrones con n = 1 y l = m = 0.
Cuando n = 2, solo puede haber ocho combinaciones de los cuatro números cuánticos.
| n |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
| l |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
| m |
0 |
0 |
+l |
+l |
0 |
0 |
–1 |
–1 |
| s |
+1/2 |
–1/2 |
+1/2 |
–1/2 |
+1/2 |
–1/2 |
+1/2 |
–1/2 |
De la misma manera, para n = 3, el número máximo de electrones es 18; para n = 4 es 32, para n = 5 es 50, etc. En general, el número máximo de electrones en un átomo que pueden tener el mismo número n es 2n2.
En la tabla 2.1 se dan las funciones de onda para ciertos estados electrónicos.
Tabla 2.1 Funciones de onda del electrón
| Orbital |
l |
m |
θ |
φ |
θφ |
R |
| s |
0 |
0 |
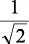 |
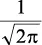 |
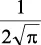 |
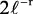 |
| p |
1 |
0 |
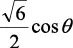 |
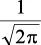 |
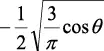 |
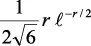 |
| 1 |
±1 |
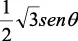 |
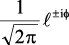 |
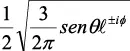 |
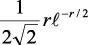 |
| d |
2 |
0 |
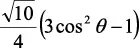 |
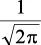 |
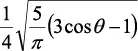 |
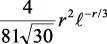 |
| 2 |
±1 |
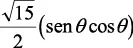 |
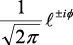 |
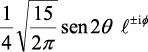 |
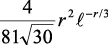 |
| 2 |
±2 |
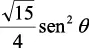 |
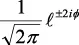 |
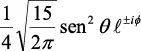 |
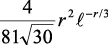 |
l: Número cuántico azimutal, m: número cuántico magnético, θφ: función angular y R: función radial
Читать дальше