5. Apliqueu el balanc. de matèria a un RCTA en estat estacionari, en el qual té Hoc en fase líquida i de manera isoterma una reacció elemental de dimerització 2 A → B.
6. La reacció A → B que és d’ordre -1 es desenvolupa en un RDTA.
a ) Escriviu una equació que represente la variació de la concentració de A en funció del temps.
b ) Escriviu una equació que permeta calcular el temps necessari perquè la concentració de A descendisca al 10 % del seu valor inicial.
c ) Podrà completar-se aquesta reacció?, podria fer-ho si fóra de primer ordre?
7. Trieu i justifiqueu:
α) Quan no s’utilitza un RDTA?
a ) Per a produir productes cars.
b ) Per a proves de nous productes.
c ) Per a minimitzar reaccions laterals.
d ) Per al processament de gran quantitat de material.
β) L’agitació és important en:
a ) Tots els reactors ideals.
b ) Tots els reactors ideals excepte el tubular.
c ) Tots els reactors ideals excepte el discontinu.
d ) Cap reactor ideal.
8. A quin dels sistemes següents s’aplica l’expressió R j= dc/dt?
a) RDTA de V constant.
b) RDTA de V variable.
c ) RCTA en estat estacionari.
d) RCTA de V constant.
9. L’expressió dc j/dt = 0 indica que no té Hoc cap reacció en el sistema?
a ) Depèn del sistema.
b ) No.
c ) Depèn de l’hora del dia.
d ) Sí.
10. L’anhídrid ftàlic es pot produir per oxidació de naftalè segons l’esquema de reacció: 2 C 10H 8+ 9 O 2→ 2C 8H 4O 3+ 4H 2O + 4CO 2. Construïu una taula estequiomètrica per a aquesta reacció quan es desenvolupa en un RDTA de volum constant, partint d’una mescla inicial que conté un 15 % de naftalè i un 85 % d’aire (% molars). En aquesta taula ha d’aparèixer la pressió parcial i la concentració de cada espècie en funció de la conversió de naftalè. Així mateix, escriviu una expressió per a la pressió total, també en funció de la conversió de naftalè.
11. Estem estudiant una reacció amb un RDTA; quan vam trobar les condicions més adequades, el temps de reacció per a aconseguir la conversió desitjada és 10 min. Si aquesta mateixa reacció i en les mateixes condicions es vol portar a terme en un reactor continu de 500 L, quin cabal ha de circular per a aconseguir la mateixa conversió en: a) un RCTA b) un RFP?
12. La reacció en fase gas 2 A + B → 2 C és irreversible i de primer ordre respecte de A, i de segon ordre respecte de B. Trieu l’expressió correcta entre les següents de forma raonada:
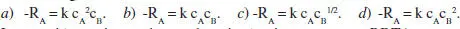 La reacció anterior es desenvolupa isotèrmicament en un RDTA a pressió constant. Escriviu l’equació de velocitat elegida en funció de k, c A0, θ B, ε k, i X . Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la proporció estequiomètrica sense presència d’inert. Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la següent proporció: 25% de A, 25 % de B i 50 % d’inerts. Per a la composició initial assenyalada, expresseu la velocitat de reacció en funció únicament de X. La concentració initial de A és 10" 3mol/L, i k a la temperatura d’operació val 10 5(mol/L) 2s -1. Calculeu el temps necessari per a aconseguir una conversió del 90 % en aquest reactor. Calculeu el volum de reactor (RCTA i RFP) necessari per a aconseguir una conversió del 90 % si el cabal alimentat és de 6 L/s.
La reacció anterior es desenvolupa isotèrmicament en un RDTA a pressió constant. Escriviu l’equació de velocitat elegida en funció de k, c A0, θ B, ε k, i X . Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la proporció estequiomètrica sense presència d’inert. Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la següent proporció: 25% de A, 25 % de B i 50 % d’inerts. Per a la composició initial assenyalada, expresseu la velocitat de reacció en funció únicament de X. La concentració initial de A és 10" 3mol/L, i k a la temperatura d’operació val 10 5(mol/L) 2s -1. Calculeu el temps necessari per a aconseguir una conversió del 90 % en aquest reactor. Calculeu el volum de reactor (RCTA i RFP) necessari per a aconseguir una conversió del 90 % si el cabal alimentat és de 6 L/s.
13. Considereu la reacció en fase gas en què un dels productes condensa immediatament després de ser format: A(g) + 2 B(g) → C(g) + D(l). La reacció és de primer ordre respecte de A i de primer ordre respecte de B. Escriviu l’equació de velocitat en funció únicament de X, considerant que la reacció es desenvolupa isotèrmicament en un reactor tubular, F aliment és equimolar en A i en B, es pot menysprear el volum de líquid format. Dades i Notes. k = 10 4L/ mol s. c A= 0.02 mol/L. T = 32 "C. Pressió de vapor de D = 1 mm Hg.
14. Calculeu el temps necessari per a obtenir un 75 % de conversió en un RDTA per al sistema A → R, sabent que es necessita una hora per a aconseguir una conversió del 50 % i que la cinètica és de primer ordre. Raoneu la resposta. Es valorarà 1'absèntia de càlculs.
Problemes
1. Determineu la relació X-τ per a la reacció del problema 2.9 en un RCTA i en un RFP, ambdós isoterms. Per a aquests reactors, calculeu la conversió que s’aconseguiria per a distintes temperatures i un τ = 10 min. Repetiu el càlcul per a altres valors del temps espacial (5 i 1 min). Representeu aquestes variations sobre el diagrama obtingut en el problema 2.9.
2. Es vol obtenir acetat de butil en un RDTA que ha de treballar a 100 °C (isotèrmicament). La mescla initial estarà constituïda per butanol i àcid acètic, en la proporció molar de 4.97:1. Així mateix, contindrà un 0.032 % en pes de fLSC", que actua com a catalitzador. Calculeu:
1) El temps necessari per a assolir un grau de conversió del 50 %.
2) Per aquest grau de conversió, la quantitat initial de cada reactiu per càrrega i el volum útil del reactor necessaris, si es vol obtenir una producció de 50 kg/h, utilitzant un sol reactor i sabent que la càrrega, descàrrega i posada al punt, entre cada dues operations consecutives, costa 30 min. Es partirà de la mescla initial indicada en el primer paràgraf.
Dades i Notes. Per al sistema en qüestió, la velocitat de reacció és de segon ordre respecte a l'acid acètic, és a dir, r (kmol/m 3s) = k c 1 2, on k = 0.29 10 -3m 3/kmol de A 1s. Les propietats físiques dels components del sistema es mostren en la taula P3.2. Encara que la densitat de la mescla reactiva varia amb la conversió, l’excés de butanol utilitzat redueix la magnitud del canvi. Per tant, en primera aproximació, la densitat mitjana del conjunt pot considerar-se constant al llarg de la reacció i igual a 750 kg/m 3.
TAULA P3.2
Propietats físiques dels components del sistema

3. Es vol hidrolitzar anhídrid acètic en un RCTA isoterm en què inicialment s’introdueixen 10 L d’una solució aquosa que conté 0.5 10 -4kmol/m 3d’anhídrid acètic. En una operació típica de posada en marxa, es connecta l’agitador, una vegada s’ha introduït la càrrega inicial, i s’escalfa el reactor fins que la mescla aconsegueix la temperatura de reacció: 313 K. A continuació, comença a introduir-se en el reactor un corrent consistent en una dissolució aquosa d’anhídrid acètic, la concentració de la qual és de 3 10 -4kmol d’anhídrid/m 3, amb un cabal volumètric de 0.12 m 3/h, mentre que es drena constantment un corrent de producte d’igual cabal volumètric. Si la reacció és irreversible i de primer ordre respecte a l’anhídrid acètic, calculeu la concentració d’aquest component i d’àcid acètic en la dissolució que ix del reactor al cap d’un temps de reacció de 3 min i al cap d’un temps de reacció infinit. Compareu aquests valors amb la situació corresponent a l’estat estacionari. Dades i Notes . Es pot admetre que la densitat de la mescla reactiva roman constant durant tota la reacció. A la temperatura de reacció, la constant de velocitat val k = 6.33 10 -3s -1. Suposeu que la reacció està pràcticament conge-lada fins al moment en què comença a introduir-se la dissolució d’anhídrid acètic en el reactor.
Читать дальше

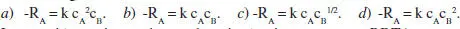 La reacció anterior es desenvolupa isotèrmicament en un RDTA a pressió constant. Escriviu l’equació de velocitat elegida en funció de k, c A0, θ B, ε k, i X . Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la proporció estequiomètrica sense presència d’inert. Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la següent proporció: 25% de A, 25 % de B i 50 % d’inerts. Per a la composició initial assenyalada, expresseu la velocitat de reacció en funció únicament de X. La concentració initial de A és 10" 3mol/L, i k a la temperatura d’operació val 10 5(mol/L) 2s -1. Calculeu el temps necessari per a aconseguir una conversió del 90 % en aquest reactor. Calculeu el volum de reactor (RCTA i RFP) necessari per a aconseguir una conversió del 90 % si el cabal alimentat és de 6 L/s.
La reacció anterior es desenvolupa isotèrmicament en un RDTA a pressió constant. Escriviu l’equació de velocitat elegida en funció de k, c A0, θ B, ε k, i X . Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la proporció estequiomètrica sense presència d’inert. Calculeu el valor de ε kquan els reactius A i B s’alimenten al reactor en la següent proporció: 25% de A, 25 % de B i 50 % d’inerts. Per a la composició initial assenyalada, expresseu la velocitat de reacció en funció únicament de X. La concentració initial de A és 10" 3mol/L, i k a la temperatura d’operació val 10 5(mol/L) 2s -1. Calculeu el temps necessari per a aconseguir una conversió del 90 % en aquest reactor. Calculeu el volum de reactor (RCTA i RFP) necessari per a aconseguir una conversió del 90 % si el cabal alimentat és de 6 L/s.











