3.2.2 ßAR –Regulierung
Eine regelkreisartige Modulierung der ß-adrenergen Rezeptoren verhindert eine Dauerreizung und übermäßige AC9-Aktivierung. ßAR werden bei hohem intrazellulärem cAMP-Gehalt durch PKAs [190] und u.a. durch Proteinkinase C (PKC) [191] phosphoryliert und desensitisiert. Diese Rezeptor-Phosphorylierung ist unspezifisch und als Nebenprodukt einer induzierten Phosphorylierungsaktivität der Proteinkinasen anzusehen (heterologe Desensitisierung), die auch durch TNFα und IL-1ß ausgelöst werden kann [192-194].
ßAR können jedoch auch durch eine spezifisch ß-adrenerge Rezeptorkinase (BARK) 3desensitisiert werden (homologe Desensitisierung). BARKs werden zunächst durch eine PKA aktiviert und erhöhen dann durch Phosphorylierung des ß-Rezeptors dessen Affinität für eine weitere Klasse von Proteinen, den Arrestinen (ß-Arrestinen). Durch die Bindung von ß-Arrestin an den phosphorylierten Rezeptor kommt es zur Entkopplung des Rezeptors von dem gebundenen und aktivierten G-Protein und dadurch zu seiner Inaktivierung [196, 197] 4. Die Phosphorylierung des Rezeptors durch die BARK erfolgt sehr rasch (< 2 Minuten) und ist in manchen Fällen persistent [171: S. 82 2. Absatz, 180: S. 6]. Die an ßAR gebundenen, desensitisierenden Phosphatreste werden kontinuierlich durch unspezifische Phosphatasen abgebaut, und die Aktivierbarkeit der Rezeptoren wird damit wiederhergestellt.
Eine anhaltende Rezeptoraktivierung führt bei ßAR zu einer vorübergehenden Reduktion der Rezeptorexpression (Downregulation) [198]. Diese Downregulation erfolgt durch endozytotische Internalisierung der Rezeptoren, kann aber auch durch eine direkte Rezeptor-Degradation in der Plasmamembran [199] bewirkt werden.
3.2.3 cAMP-abhängige Genexpression
cAMP kann die Expression von Genen regulieren, die innerhalb ihres Promotors eine bestimmte Gensequenz, das „cAMP-Response-Element“ (CREs), tragen. An diese CREs binden die sogenannten „cAMP-Responsive-Element-Binding-Proteins“ (CREBs). Das sind Transkriptionsfaktoren, die durch aktivierte PKAs, aber auch durch andere Proteinkinasen wie z.B. Calmodulin-abhängige Proteinkinase II (CaM-Kinase II) oder Mitogen-Activated Protein-(MAP)-Kinase aktiviert und reguliert werden. Vereinfachend kann man sagen, dass die Transkription eines CREB-regulierten Gens durch Anlagerung von aktiviertem CREB an CRE gestartet wird, wenn zusätzlich ein Coaktivator, das „CREB-binding Protein“ CBP, die Verbindung zwischen CREB und dem Transkriptionsstartpunkt herstellt. CREBs bilden einen zentralen Zugang zur Genexpression, der von sehr unterschiedlichen, extrazellulären Liganden und intrazellulären Signalwegen genutzt werden kann [200, 201]. U.a. induzieren ß2AR ihre eigene Synthese über den cAMP/CREB-Weg [202, 203].
3.2.4 cAMP-Quellen/ Zytosolischer cAMP-Spiegel
Der cAMP-Spiegel wird nicht nur durch ßAR-Stimulation, sondern auch durch Stimulation anderer Gs-Protein gekoppelter Rezeptoren intrazellulär erhöht: z.B. durch Dopamin (am D1R), Serotonin (am 5-HT4R, 5-HT6R und 5-HT7R, die im ZNS, PNS und GI vorkommen), Histamin (am H2R, der besonders auf Parietalzellen der Magenschleimhaut vorkommt), Prostaglandin E2 (am EP2-R und EP4-R), Prostaglandin D2 (am DP1-R) [204: S. 14-15], Glukagon, Adenosin (am A2AR- und A2BR) [205: S. 56, 206], Adrenocorticotropes Hormon (ACTH) [207], Parathormon (PTH) am PTH-R [208: S. 7-8], Duftstoffe an olfaktorischen Rezeptoren (OR) [209: S. 8-9], die Inkretine „Glucoseabhängiges insulinotropes Peptid“ (GIP) und „Glucagon-like-Peptid“ (GLP-1) [210: S. 11-13] etc., oder Rezeptor unabhängig durch Substanzen wie Forskolin [171: S. 14 Zeile 4].
Hervorzuheben ist, dass ßAR vor allen sonstigen, das AC/cAMP-System anstoßenden Rezeptoren, das mit Abstand höchste Triggerpotential für das AC/cAMP-System haben [62: S. 10 unten]. Es scheint daher berechtigt, ßAR als die wesentliche, zelluläre „cAMP-Quelle“ zu bezeichnen, auch wenn abhängig von der Organ- und Zellspezifität andere Gs-Protein koppelnde Rezeptoren wichtige Beiträge zur cAMP-Versorgung der Zellen leisten.
Zelluläres cAMP hat eine kurze Halbwertzeit von nur wenigen Sekunden bis Minuten [174: S. 9], da es ständig durch cAMP-selektive Phosphodiesterasen (PDE4, -7, -8) oder gemischtspezifische Phosphodiesterasen (PDE1, -2, -3, -10, -11), die cAMP und cGMP als Substrat haben, aufgespalten und inaktiviert wird [211]. Besonders schnell wird der zelluläre cAMP-Spiegel durch PDE2 gesenkt, deren cAMP-Hydrolysekapazität die cAMP-Synthesekapazität der ACs übersteigt [187]. Allgemein nimmt der cAMP-Abbau zu, wenn der zellulären cGMP-Gehalt sinkt: ein reduziertes cGMP-Substratangebot führt zu einem vermehrten cAMP-Abbau durch gemischtspezifische PDE.
Eine Anhebung des zytosolischen cAMP-Spiegels kann durch Aktivierung der ACs oder Hemmung von cAMP-abhängigen/gemischtspezifischen PDEs erreicht werden; umgekehrt führt eine Hemmung der ACs oder Induktion von PDEs zu einer cAMP-Spiegel Absenkung und zum Abbruch cAMP-abhängiger Prozesse.
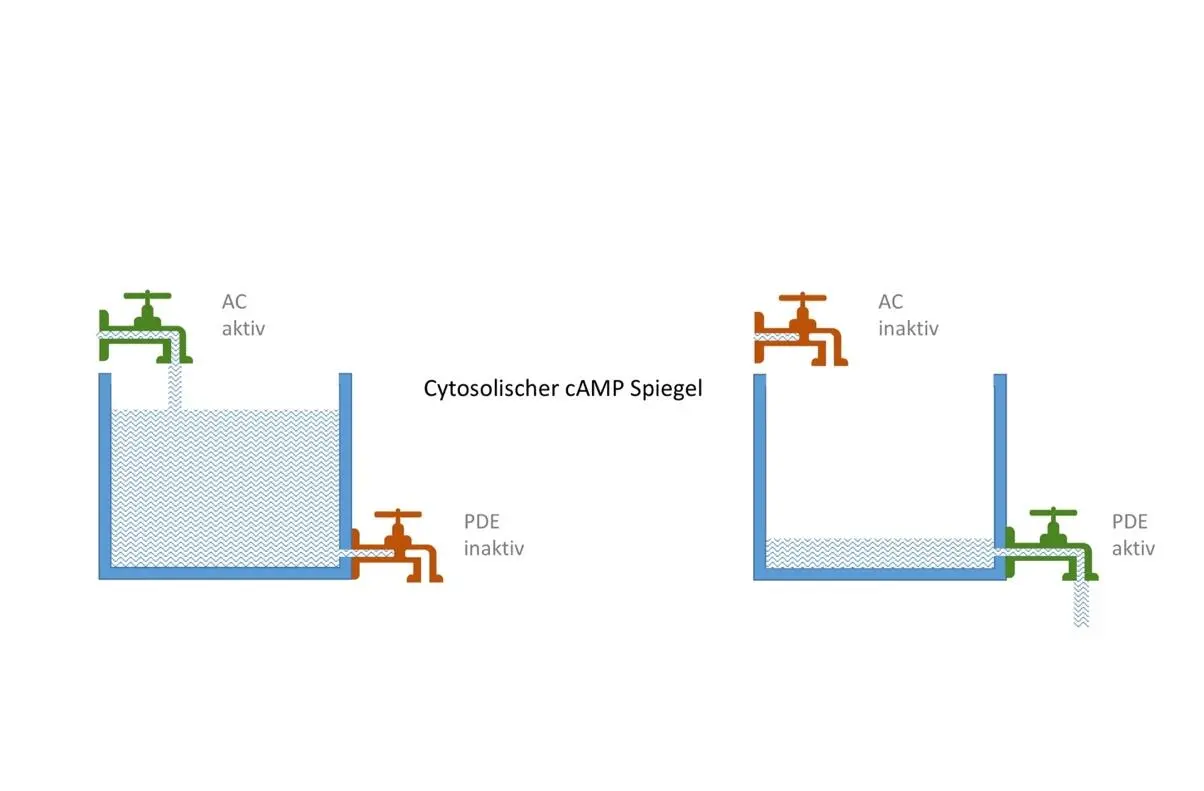
Abbildung 4: Veränderung des zytosolischen cAMP-Spiegels durch abbauende und zuführende Prozesse
3.2.5 Calcium-Regulation durch ßAR
Bei ß1AR-Stimulation am Herzen halten aktivierte PKAs spannungsabhängige Calciumkanäle länger offen, bewirken einen verstärkten Calcium-Einstrom aus dem Extrazellulärraum und fördern anschließend die Herzmuskelerschlaffung durch einen forcierten Calcium-Abfluss in das SR oder nach extrazellulär [212]. ß2AR senken an der glatten Muskulatur das freie intrazelluläre Calcium durch eine verstärkte Ca2+-Aufnahme in das sarkoplasmatische Retikulum (SR) [213, 214] und erreichen dadurch eine Relaxation.
Die zentrale Aufgabe der ßAR im Rahmen der zytosolischen Calciumregulation besteht in der Rückführung von zytosolischem Ca2+ in die zellulären Ca2+-Speicher des SR oder ER, wodurch eine Beendigung Ca2+-abhängiger Prozesse erreicht und die Voraussetzung für erneut einsetzende, Calcium abhängige Leistungen geschaffen wird [215].
Die Rückführung zytosolischen Calciums in die Speicher von SR und endoplasmatisches Retikulum (ER) wird von einer hoch effektiven Ca2+-ATPase der „Sarko/endoplasmatisches Retikulum Ca2+-ATPase“ (SERCA) geleistet 5. SERCA wird durch Bindung an Phospholamban (PLB) gehemmt. Eine SERCA-Aktivierung bedarf der Enthemmung, die durch eine cAMP/PKA-abhängige Phosphorylierung von PLB erreicht wird [216]. Die Rückführung zytosolischer Ca2+-Ionen in das SR/ER ist cAMP/PKA-vermittelt und damit stark unter ßAR-Einfluss.
3.2.6 Wirkungen von ß2AR/cAMP auf IκB und NF-κB
Zahlreiche Forschungsarbeiten belegen, dass ß2AR-Stimulation oder ansteigende zelluläre cAMP-Spiegel über PKA/CREB die Transkriptionsaktivität des nukleären Faktors NF-κB blockieren [217-220].
Spannende Forschungsergebnisse gibt es auch zur Auswirkung von cAMP auf das zelluläre IκBα-Level, das auf mindestens drei Wegen durch cAMP angehoben werden kann.
1 P. Farmer und J. Pugin (2000) konnten für Monozyten zeigen, dass Noradrenalin, Forskolin, PGE2 (Iloprost) und andere Gs-Rezeptor koppelnde Liganden eindeutig über cAMP die Aktivität des IκBα-Promotors und nachfolgend die IκBα-Expression steigern, und dadurch das IκBα-Protein-Level sowohl zytosolisch als auch nukleär signifikant anheben [221]. Entsprechendes konnten V. Gavrilyuk, D. L. Feinstein et al. (2005) für Astrozyten und deren IκBα-Expression belegen [222].
2 M. Neumann et al. (1995) haben nachgewiesen, dass in T-Lymphozyten steigende cAMP-Spiegel über PKA-Effekte das zytosolische IκBα-Level durch Inhibition der Degradation anheben [223].
Читать дальше