Da der weit überwiegende Teil der Menschen mit den kritischen HLA-Genen keine Psoriasis entwickelt, und bis heute vergeblich nach „dem“ Psoriasis-Autoantigen, das die spezifisch psoriatische Entzündung erklärt, gesucht wurde, ist anzunehmen, dass das Auftreten bestimmter MHC-I oder MHC-II-Moleküle und das Auftreten einer Veranlagung zur Psoriasis zwei unabhängige Ereignisse sind, deren gemeinsames Auftreten die Wahrscheinlichkeit für einen Ausbruch der Psoriasis deutlich erhöht. Oftmals ist es das Zusammentreffen von Eigenschaften, das zum Auslöser wird, ohne dass eine der Eigenschaften die andere bedingt. Die folgende Abbildung soll die Situation verdeutlichen:
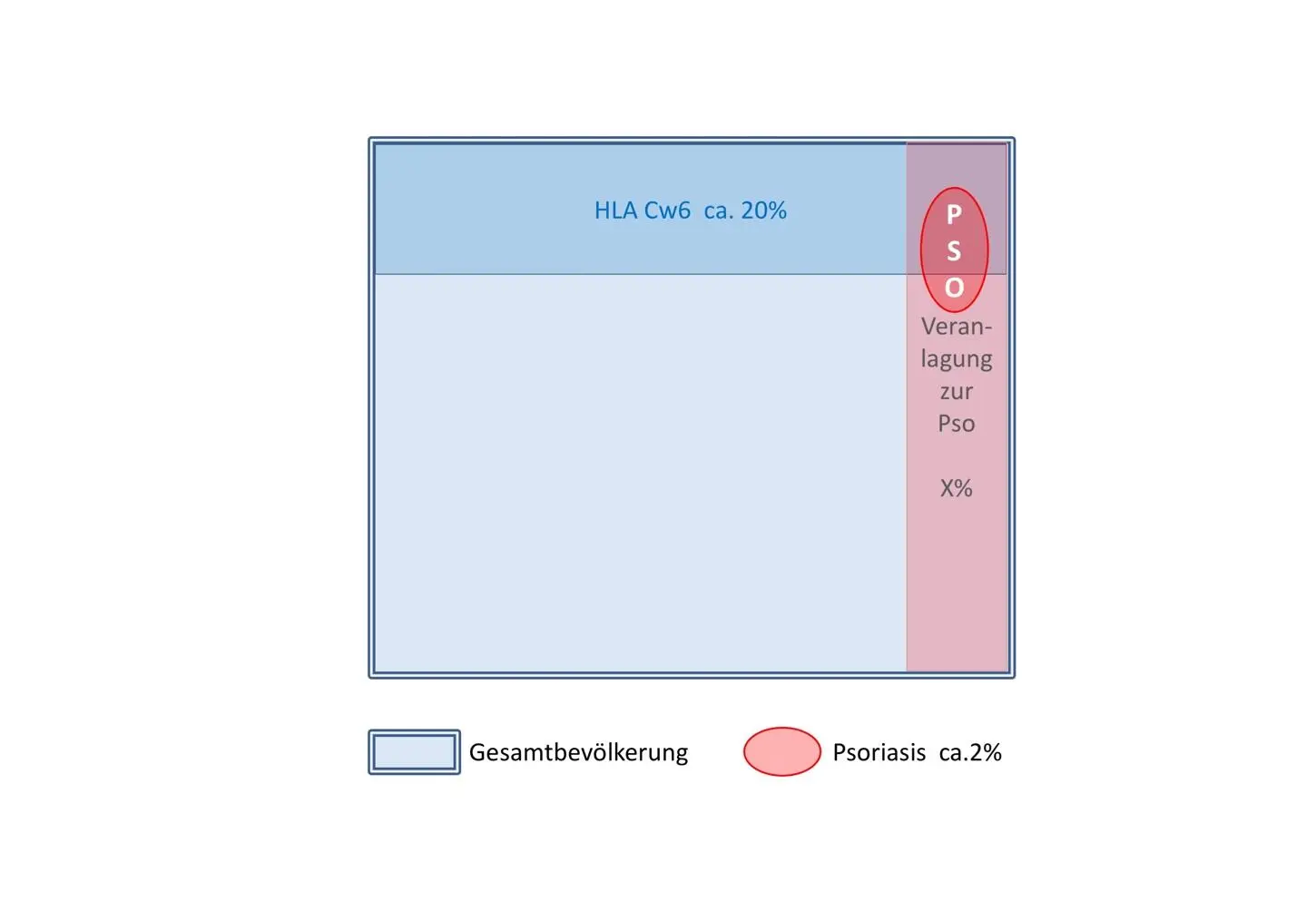
Abbildung 3: Die Assoziation zwischen Psoriasis und HLA Cw6
Das Rechteck rechts oben zeigt die Schnittmenge zwischen Vorkommen HLA Cw6 und der Veranlagung zur Psoriasis, deren Häufigkeit unbekannt ist. Die Wahrscheinlichkeit für das Auftreten einer Psoriasis unter der Voraussetzung HLA Cw6 ist deutlich erhöht und führt zu der bekannten Assoziation. Abkürzung: Pso= Manifeste Psoriasis, weiteres s. Text.
3 Vegetative Innervation, Neurorezeptoren, cAMP
Vegetative Innervation und Neurorezeptoren bilden die Grundlagen, auf denen die in den Kapiteln 4und 8 vorgestellten Ergebnisse des Reviews aufbauen. Dieses Kapitel soll vorbereitend und zur späteren Bezugnahme den aktuellen Wissensstand rekapitulieren.
3.1 Allgemeine Einführung
Das zentrale Nervensystem interagiert bidirektional und dynamisch mit dem gesamten Organismus, insbesondere auch mit dem Immunsystem, um so die Immunhomöostase aufrecht zu erhalten. Hierbei nimmt das vegetative Nervensystem mit seinem sympathischen Arm eine Schlüsselstellung als Bote zwischen Gehirn und Immunsystem ein [153: chapter 3.3.5, 154, 155]. Die wesentlichen Zielzellen der sympathischen Innervation lymphatischer Organe sind Thymozyten, T-Lymphozyten, Mφ, MC, Plasmazellen und enterochromaffine Zellen [156]. Den lymphatischen Organen, wie auch der Haut, fehlt eine direkte parasympathische, cholinerge Innervation, aber ihre Zellen exprimieren dennoch die Komponenten des cholinergen Systems und gehören damit dem nicht-neuronalen cholinergen System (NNCS) an. Das NNCS ist gekennzeichnet durch das Vorhandensein von Acetylcholin (ACh) und seinem Syntheseenzym, der Cholin-Acetyltransferase (ChAT), ferner dem hochaffinen (Na+ und Cl- abhängigen) Cholin-Transporter (ChT-1), der extrazelluläres Cholin in die Zelle einschleust [157-159] und der ACh abbauenden Acetylcholinesterase (AChE). Ferner gehören muskarinische (mAChRs) und nikotinische (nAChRs) Rezeptoren zur Ausstattung des NNCS [157, 160, 161].
Die parasympathische, neuronale Versorgung erreicht über Hirnnerven, N. vagus, Nn. splanchnici und Effektor nahe Ganglien oder Plexus, soweit bekannt, nur Sinnesorgane und die nichtlymphatischen, inneren Organe. Ein Gewebe, das keine direkte parasympathische Anbindung hat, kann mit ACh wegen dessen kurzer Halbwertzeit nicht über die Blutzirkulation versorgt werden. In diesen Geweben ist ACh i.d.R. auto-oder parakrinen Ursprungs [162]. Das parasympathische System kann dennoch Einfluss auf die nicht direkt von ihm innervierten Bereiche nehmen, indem es sich gezielt sympathischer Innervation bedient. Dies ist z.B. der Fall bei dem extrem schnellen, vom ZNS ausgehenden „cholinergen antiinflammatorischen Signalweg“ zur Kontrolle Endotoxin vermittelter TNFα Ausschüttung in der Milz: in der Milz produzierte Zytokine stimulieren über afferente Bahnen die Stressachse des Hypothalamus mit nachfolgender zentraler Vagusreizung. Der N. Vagus leitet die Erregung über nikotinische α7-nAChR (n-AChR s. 3.4.1) autonomer Ganglien weiter an den sympathischen Milznerven und führt so zu einer Katecholamin vermittelten Inhibition überschießender, inflammatorischer Zytokinproduktion [163-165].
Die Haut und insbesondere auch die Epidermis sind von einem Geflecht somatosensorischer Nervenfasern durchzogen. Die intraepidermalen, sensorischen Nervenfasern (IENF) sind nackte Nervenfasern, die dermalen Nerven entspringen, zur Oberfläche der Epidermis aufsteigen und sich innerhalb der Epidermis mit einigen horizontalen Ästen verzweigen [166]. KC und andere epidermisständige Zellen kommunizieren mit den IENF durch parakrine Stimulation, unterstützen deren sensorisches Signalling [167] und werden umgekehrt durch Neuropeptide der IENF stimuliert [167]. Die sympathischen Fasern der Dermis erreichen ihre Versorgungsgebiete zusammen mit den sensiblen Hautnerven [168], innervieren dermale Strukturen wie Schweißdrüsen, Blutgefäße und Haarfollikel und reichen zumindest bis an die dermo-epidermale Junktionszone [167]. Eine sympathische Innervation der Epidermis wird von modernen Autoren kategorisch ausgeschlossen [167], wurde jedoch von dem Anatom F. Kiss (1958) beschrieben [169]. Für die lymphatischen Organe konnten S. Y. Felten et al. (1991, 1992) die Innervation durch sympathische Nervenfasern zeigen [170]; in elektronenmikroskopischen Studien der Milz wurde ein direkter Kontakt der Nervenendigungen mit Lymphozyten und Mφ sichtbar gemacht [171: S. 10].
Da die Haut sympathisch, aber nicht parasympathisch innerviert ist, werden cholinerge Impulse hier über das NNCS generiert. Dem NNCS gehören auch KC und T-Zellen an, die in jeder Reifungsphase charakteristische cholinerge/ adrenerge Rezeptor-Kombinationen tragen [172, 173, 174: S. 12] und zu auto- und parakriner Sekretion von ACh und Katecholaminen befähigt sind [153, 175]. KC besitzen in vollem Umfang die Kapazität zur Katecholamin-Synthese und zum Katecholaminabbau [176].
3.2 ß-Adrenozeptoren (ßAR)
ß-Adrenozeptoren, mit den bekannten Subtypen ß1, ß2 und ß3, sind membranständige Rezeptoren und gehören zur Klasse der G-Protein-gekoppelten Rezeptoren (GPCR). Herzmuskel und juxtaglomeruläre Zellen der Niere exprimieren ß1-Adrenozeptoren zur Herzkraftregulation, respektive Reninausschüttung. ß3-Adrenozeptoren sind im braunen Fettgewebe lokalisiert und dienen der Wärmeregulation. ß2-Adrenozeptoren findet man in allen Körperorganen und Geweben; sie sind damit gewissermaßen die Normvariante der ß-Adrenozeptoren. In der Haut werden sie u.a. von KC, ekkrinen Schweißdrüsen [177] und dermalen Blutgefäßen exprimiert [178].
3.2.1 Signalübertragung der ßAR
Alle Subtypen der ßAR leiten ihre Signale i.d.R. über stimulierende G-Proteine (Gs-Proteine) weiter. G-Proteine sind heterotrimere, GTP-bindende Proteine, die durch eine Rezeptoraktivierung ihren aktiven Funktionszustand erlangen und im Falle der Gs-Proteine zur Aktivierung der Adenylatzyklase (AC) und damit zur Synthese des „second messenger“ cAMP aus ATP führen. ß2AR stimulieren über die α-Untereinheit heterotrimerer Gs-Proteine, die Gαs-Proteine, die Adenylatzyklase Typ9 (AC9 = ADCY9) [179], deren Syntheseleistung bei ca. 1000 cAMP-Molekülen pro Minute liegt [174: S. 9 4. Absatz]. Dabei aktiviert ein funktionsfähiger, Gs-gekoppelter ßAR mehrere Gαs-Proteine, und bewirkt dadurch Signalamplifikation [180: S. 4]. ß1AR und ß2AR stimulieren die cAMP-Synthese in gleichem Umfang [181]. Die AC9 ist anders als die übrigen ACs unempfindlich gegenüber der Aktivierung durch Ca2+/Calmodulin und Forskolin, einem Rezeptor unabhängigen AC-Aktivator [179]. Von Bedeutung ist ferner, dass die Aktivität der AC9 durch Diacylglycerin/Proteinkinase C (s.u.) gehemmt werden kann [182].
Cyclisches AMP aktiviert Proteinkinasen A (PKAs) und das „Exchange Protein Directly Activated by cAMP“ (EPAC). Zusätzlich kann es direkt „Cyclic Nucleotide-Gated ion channels” (CNG)-Kanäle aktivieren und dadurch einen depolarisierenden Ca2+-Einstrom aus dem Extrazellularraum einleiten [183]. Typische Zielstrukturen, die durch PKAs phosphoryliert werden, sind Rezeptoren, Ionenkanäle, Transkriptionsfaktoren wie CREB (s. 3.2.3), Phosphodiesterasen, Calmodulin-abhängige Kinasen (CaMK) [184], Ionenpumpen und diverse Stoffwechselenzyme [185: S. 411 ff., 186: S. 10 2. Absatz]. EPAC reguliert u.a. Integrinexpression und Exozytose [187] und ist an Prozessen der Zelldifferenzierung, Proliferation, Apoptose und Genexpression beteiligt [188: S. 18, 189].
Читать дальше