En muchos casos, como ocurre en organismos introducidos inadvertidamente, la abundancia durante esta etapa aún sigue siendo tan reducida que la especie, pese a estar presente en un área, no es percibida. La fracción de tiempo en que la especie exótica permanece en reducidos niveles poblacionales se denomina retraso ( time lag ), y está asociado a la necesidad de disponer de suficiente diversidad genética o número de organismos que propicien el crecimiento posterior (Mack et al. 2000; Sakai et al. 2001).
| FIGURA 5.2 |
| Se ilustra la expansión demográfica de la opuntia Opuntia aurantiaca en Sudáfrica, indicando el área de ocupación a lo largo del tiempo (Moran & Zimmerman 1991). Luego de su introducción, la especie permanece por largo tiempo a baja densidad ocupando un área reducida hasta que aumenta su población y el área ocupada (en torno a 1930). Alrededor de 1960, la población comienza a declinar su tasa de ocupación territorial hasta establecerse en torno a las 800.000 hectáreas. |
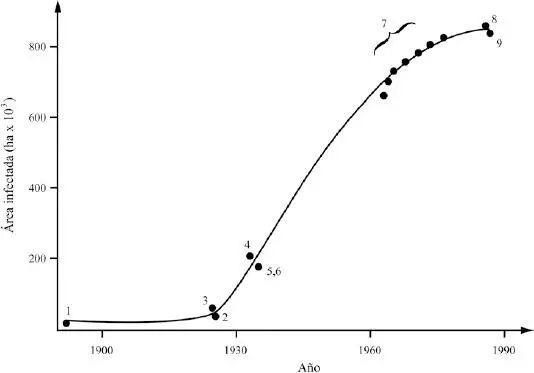 |
Como se mencionó anteriormente, durante la fase de retraso es difícil determinar el destino de la colonia fundadora. Cuántas y cuáles de ellas llegarán a convertirse en pestes, representa uno de los principales focos de atención en el manejo y control de las invasiones. En los casos en que las especies exóticas llegan a ser pestes, los costos económicos para su control son elevados, y su erradicación es virtualmente impensable. En atención a evitar futuros efectos indeseados, se ha señalado la conveniencia de detectar y controlar las invasiones en etapas tempranas, pues se facilita considerablemente el trabajo sobre poblaciones reducidas y de distribución geográfica restringida (Pyšek & Richardson 2010).
Luego de esta etapa, la población experimentará un crecimiento poblacional dando paso a una mayor abundancia ( Figura 5.2). Es en este punto en que la abundancia de campo puede superar cierto umbral, haciendo perceptible o evidente la presencia de la especie exótica. Sin embargo, como ocurre con toda población, el crecimiento exponencial no puede ser mantenido indefinidamente, por lo que eventualmente la tasa de crecimiento se reducirá, llevando a la población a su capacidad de carga, K (Gotelli 2001).
Recientemente, Arim et al. (2006) documentaron la existencia de patrones y mecanismos generales en el crecimiento poblacional de especies exóticas irruptivas. Estos autores compararon la dinámica de crecimiento poblacional para 30 especies –pertenecientes a taxa tan diversos como virus, plantas, invertebrados, peces, anfibios y aves–, encontrando mecanismos de regulación poblacional consistentes para todos estos casos, hecho que hasta ese momento no había sido demostrado empíricamente. Dichos mecanismos responden a dinámicas de primer orden, es decir, competencia intraespecífica como consecuencia del incremento de la densidad, la cual se produciría en el frente de expansión. Estos autores atribuyen el retardo en el crecimiento del frente de expansión al hecho de que este frente se genera a partir de un segmento poblacional menos reproductivo, que compite por espacios para establecerse antes de generar la progenie que seguirá ampliando el frente de expansión. Estos resultados contrastan con aquellas apreciaciones que concebían las invasiones como fenómenos de crecimiento poblacional irruptivo, descontrolado y de naturaleza idiosincrática, ya que evidencia la presencia de mecanismos demográficos comunes para una amplia variedad de taxa.
 Reacción-difusión en la naturaleza
Reacción-difusión en la naturaleza
Hasta ahora, la modelación basada en ecuaciones de reacción-difusión ha mostrado ser una herramienta útil para derivar algunas propiedades del proceso invasivo. Pero, ¿qué tan útiles pueden ser al momento de ponerlos a prueba bajo condiciones de campo?
Skellam (1951) fue uno de los primeros investigadores en evaluar el ajuste de la expansión de la rata almizclera ( Ondatra zibethicus ) en Europa central, a modelos de ecuaciones de reacción-difusión. Basado en los muestreos previos realizados por Ulbrich (1930), Skellam confeccionó un mapa donde se aprecia el rango adquirido por la especie a lo largo del tiempo (véase Figura 5.3). La rata almizclera fue introducida bajo cautiverio en República Checa con el propósito de estimular la industria peletera; pero en 1909, cinco individuos escaparon en la ciudad de Praga, dando origen a uno de los focos de invasión mejor conocidos de esta especie en Europa (Hengeveld 1989). Skellam (1951) estimó el área ocupada por Ondatra zibethicus entre 1909 y 1928, y calculando la raíz cuadrada de este valor, obtuvo una relación constante para la velocidad de crecimiento del rango ( Figura 5.4), un valor cercano al crecimiento del radio de expansión concéntrica visualizado en la Figura 5.1 A. Más allá de este caso particular basado en Ondatra zibethicus , Skellam entendió que en términos generales, la expansión de plantas y animales presenta un comportamiento que responde a las predicciones teóricas de modelos de reacción-difusión (Ecuación 3). Las desviaciones observadas a los modelos las atribuyó a particularidades ecológicas tanto de las especies en expansión como de los hábitats a través de los cuales los organismos se expanden.
En Sudamérica, la invasión de algunos vertebrados ha sido estudiada desde una perspectiva más bien empírica, pero inspirada en la búsqueda de parámetros presentes en las ecuaciones de reacción-difusión. Jaksic et al. (2002) recopilaron información respecto de la velocidad de expansión de la liebre europea ( Lepus europaeus ), el conejo europeo ( Oryctolagus cuniculus ), el castor canadiense ( Castor canadensis ), la rata almizclera ( Ondatra zibethicus ) y el visón americano ( Neovison vison ). Dependiendo de los taxa, las tasas de expansión mostraron amplia variación, llegando a extremos entre 2,7 y 20,0 km por año para el castor y la liebre europea, respectivamente (véase Tabla 5.1). Esta variación también fue notable al comparar las estimaciones obtenidas para una misma especie en diferentes localidades. Por ejemplo, para Oryctolagus cuniculus la velocidad de expansión se ha estimado entre 7,0 y 16,0 km/año, mientras que en el caso de Castor canadensis los valores oscilan entre 2,7 y 6,3 km/año ( Tabla 5.1). Estas diferencias en las tasas de expansión responderían a desigualdad en los atributos de permeabilidad del paisaje, que en el caso del castor podría estar dado por la extensión geográfica de la red de microcuencas que limita su velocidad de expansión (Skewes et al. 1999).
| FIGURA 5.3 |
| Expansión geográfica de la rata almizclera ( Ondatra zibethicus ) en Europa central, entre 1907 y 1963, a partir del sitio original de introducción (la ciudad de Praga, en la República Checa; Skellam 1951). |
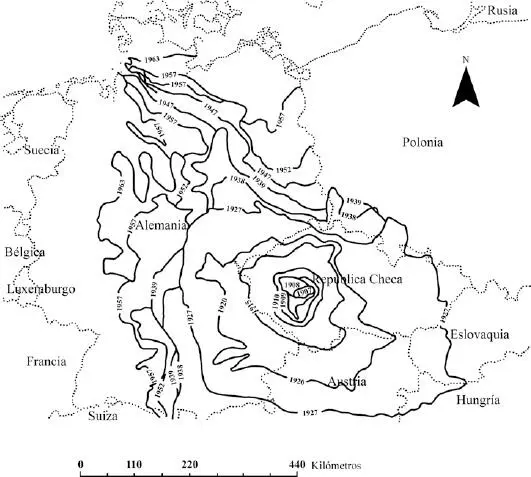 |
| FIGURA 5.4 |
| Relación funcional entre el área de ocupación de la rata almizclera ( Ondatra zibethicus ) en Europa central a lo largo del tiempo (Skellam 1951). |
 |
Entre estas especies, particularmente interesante es el caso de la liebre europea ( Lepus europaeus ) cuya invasión fue revisada por Bonino et al. (2008). La liebre fue introducida inicialmente en Argentina durante el siglo XIX, al menos en tres localidades diferentes (Grigera & Rapoport 1983). Desde aquí, se expandió ocupando todo el Cono Sur sudamericano, incluyendo Chile, Uruguay, Paraguay, Bolivia y Perú ( Figura 5.5). Estudiando su velocidad de expansión, Cossíos (2004) registró una velocidad de 44 y 34 km/año en Perú y Bolivia, respectivamente. En Brasil, Grigera & Rapoport (1983) registraron una tasa promedio de 37 km/año, mientras que en Paraguay varió entre 10 y 17 km/año (Bonino et al. 2008). De acuerdo a estos resultados, Bonino et al. (2008) especularon que la liebre europea continuará expandiéndose hacia el norte de Sudamérica, especialmente en la porción occidental del continente. En cambio, en la porción central y oriental, la selva amazónica podría representar una barrera severa a su expansión.
Читать дальше


 Reacción-difusión en la naturaleza
Reacción-difusión en la naturaleza