Método de concentración de formol-éter
Materiales y reactivos
Los materiales y reactivos necesarios para este método son: vasos desechables, aplicadores, bajalenguas, gasas, tubo de centrífuga, portaobjetos, cubreobjetos, formol al 10 % (ver anexo 3), éter etílico, solución salina al 0.85 % (ver anexo 1) y lugol (ver anexo 2) (8,10).
Procedimiento
1. Tomar aproximadamente 1 g de materia fecal con un bajalenguas y colocar la muestra en un vaso desechable.
2. Agregar 10 ml de formol al 10 % y homogenizar.
3. Filtrar a través de gasa doble en un tubo de centrífuga.
4. Agregar 1 ml de éter etílico y mezclar vigorosamente durante un minuto.
5. Centrifugar a 800 g durante 5 minutos.
6. Eliminar el sobrenadante.
7. Mezclar el sedimento con un aplicador y realizar el montaje en solución salina al 0.85 % y solución de lugol, como se describió en el aparte que referencia el examen directo en materia fecal.
Con este método se aumenta la probabilidad de encontrar los quistes u ooquistes de los protozoarios en las muestras.
Técnica de Ritchie-Frick modificada
Materiales y reactivos
Los materiales y reactivos necesarios para este método son los mismos que se utilizan en el método de concentración de formol-éter y solución alcohólica (ver anexo 4) (3,11,28).
Procedimiento
Con el fin de identificar protozoos intestinales, primero se lleva a cabo el protocolo para la identificación de helmintos y luego se continúa con el procedimiento para la identificación de protozoos.
Identificación de helmintos
1. Mezclar 2 g de materia fecal y 15 ml de formol al 10 % en un frasco.
2. Homogenizar y mezclar por agitación.
3. Filtrar a través de dos capas de gasa en tubo de centrífuga.
4. Centrifugar a 800 g durante 10 minutos.
5. Anotar el volumen del sedimento y descartar el sobrenadante.
6. Multiplicar el volumen del sedimento por 7, agregar este valor en volumen de solución alcohólica y mezclar.
7. Colocar 0.05 ml de la suspensión en un portaobjetos, colocarle un cubreobjetos y observar al microscopio.
8. Realizar los recuentos de huevos y larvas de helmintos, promediar y multiplicar el valor por 160 en cada caso; este valor corresponde al número de huevos o larvas por mililitro de heces filtradas y sedimentadas.
Identificación de protozoarios
1. Completar el volumen restante de la suspensión anterior con solución alcohólica y centrifugar a 800 g durante 10 minutos.
2. Eliminar el sobrenadante y agregar el mismo volumen de solución alcohólica.
3. Agregar 3 ml de éter y homogenizar.
4. Centrifugar a 800 g durante 10 minutos.
5. Eliminar el sobrenadante.
6. Colocar en un portaobjetos una gota de la suspensión para lugol y solución salina al 0.85 %, colocar un cubreobjetos y observar al microscopio con objetivos de 10X y 40X, que posean micrómetro ocular.
Este método aumenta la probabilidad de encontrar los quistes u ooquistes de los protozoarios en las muestras examinadas.
Reporte de resultados
Las especies patógenas y no patógenas halladas en la muestra deben ser reportadas. Si se encuentran especies no patógenas, se considera como un indicio de que el paciente ha ingerido alimentos o bebidas contaminadas con materia fecal, lo cual sugiere una asociación con especies patógenas (29,30). Si se encuentran formas parasitarias morfológicamente compatibles con E. histolytica, se debe reportar como complejo E. histolytica/E. dispar/E. moshkovskii (31).
Identificación del complejo Entamoeba histolytica/ Entamoeba dispar/Entamoeba moshkovskii
A continuación, se describen las técnicas utilizadas para la identificación del complejo E. histolytica/E. dispar/E. moshkovskii, las cuales incluyen el examen con azul de metileno amortiguado y las coloraciones especiales.
Examen con azul de metileno amortiguado
Materiales y reactivos
Los materiales y reactivos necesarios para este método son: portaobjetos, cubreobjetos, tubo de ensayo, aplicador, solución amortiguadora de acetato (ver anexo 17) y azul de metileno amortiguado (ver anexo 18) (7,31,32).
Procedimiento
1. Tomar una pequeña cantidad de materia fecal con un aplicador y llevarla a un tubo de ensayo.
2. Mezclar con una pequeña cantidad de azul de metileno amortiguado.
3. Incubar a 37 °C durante 15 minutos.
4. Hacer el montaje en un portaobjetos y colocarle un cubreobjetos.
5. Examinar la preparación en 10X y 40X.
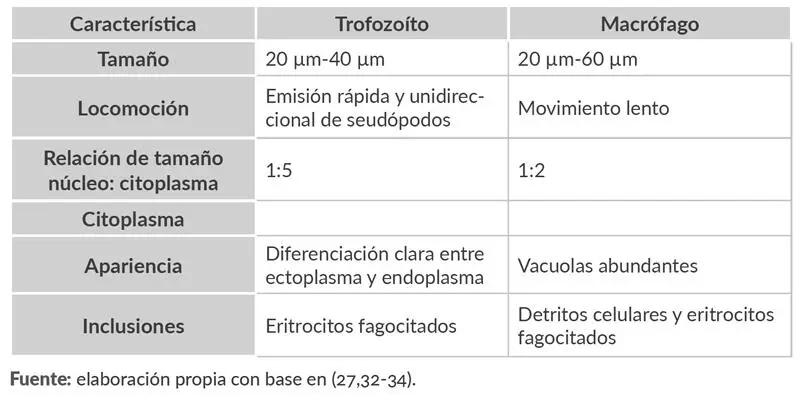
A través de esta técnica, es posible observar las características morfológicas del núcleo de los trofozoítos. Esta característica y otros aspectos morfológicos enumerados en la tabla 1.2
facilitan la diferenciación de los trofozoítos de los macrófagos, los cuales también suelen estar presentes en la muestra y son un factor de confusión frecuente.
Tabla 1.2. Cuadro comparativo de las características de los trofozoítos y los macrófagos de
Coloraciones especiales
Las coloraciones especiales descritas a continuación incluyen la tinción con hematoxilina férrica y la tinción tricrómica.
Tinción de hematoxilina férrica
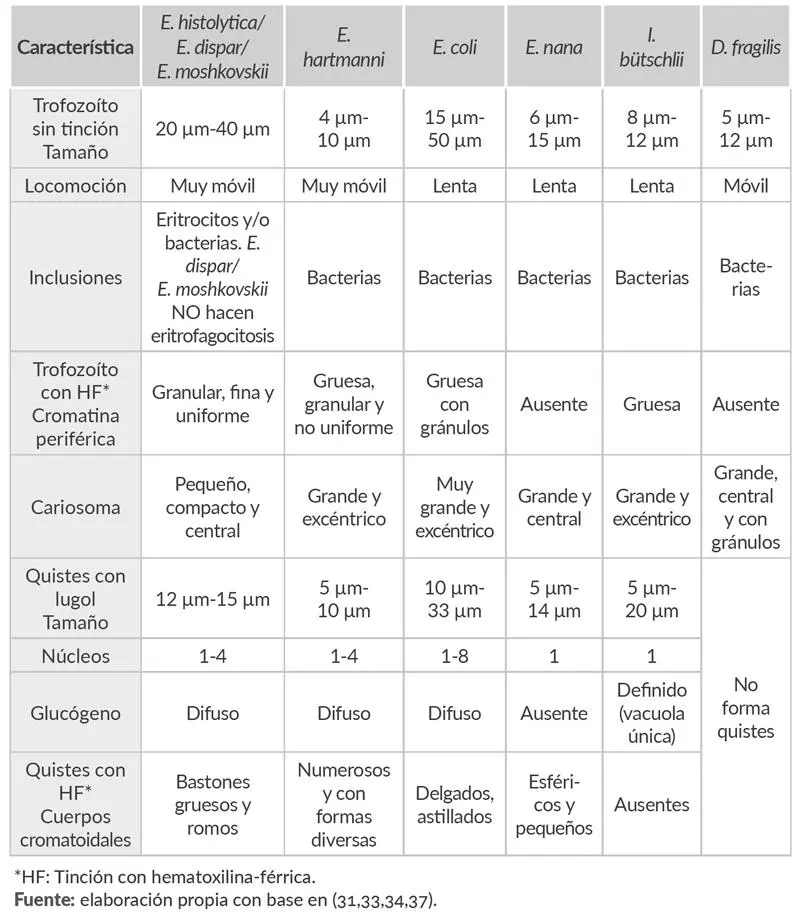
Esta técnica permite detallar la morfología del núcleo, el cariosoma, la membrana y la distribución de la cromatina, los cuerpos cromatoides y las vacuolas (35,36) como se puede observar en la tabla 1.3
.
Tabla 1.3. Comparación de la morfología del complejo E. histolytica/E. dispar/E. moshkovskii y otras amibas intestinales.
Materiales y reactivos
Los materiales y reactivos necesarios para este método son: tubo de cultivo de amibas o materia fecal, gasa, vasos desechables, tubos, centrífuga, agua destilada, papel secante, aplicadores, portaobjetos, soporte metálico, cubreobjetos, recipientes rectangulares con tapa, guantes desechables, tapabocas, fijador de Schaudinn (ver anexo 19), fijador de alcohol polivinílico (PVA, por su sigla en inglés) (ver anexo 20), etanol al 30 %, 50 %, 70 %, 85 % y 90 % (ver anexo 21), solución de albúmina (ver anexo 22), solución saturada de alcohol yodado (ver anexo 23), alumbre férrico (ver anexo 24), hematoxilina al 5 % (ver anexo 25), solución de ácido pícrico (ver anexo 26), xilol y líquido de montaje (citorresin).
Procedimiento
1. Mezclar una parte de heces recién emitidas con tres partes de fijador de Schaudinn o fijador PVA y conservar hasta el momento de la coloración.
2. Filtrar la mezcla anterior con un pedazo de gasa.
3. Centrifugar el filtrado a 800 g durante 10 minutos.
4. Eliminar el sobrenadante, resuspender el sedimento con agua destilada y centrifugar a 400 g durante 10 minutos. Repetir este procedimiento mínimo tres veces o hasta obtener un sobrenadante transparente.
5. Preparar el etanol al 30 %, 50 %, 70 %, 85 % y 95 % a partir de alcohol al 100 %.
6. Preparar la solución saturada de alcohol yodado.
7. Montar los portaobjetos. Escurrir bien el líquido del tubo, colocarlo boca abajo sobre un papel secante durante unos pocos segundos y agregarle varias gotas de solución de albúmina para disolver el sedimento (entre cuatro o cinco gotas).
8. Tomar una gota del preparado y colocarla sobre un portaobjetos. Extenderla horizontalmente con un aplicador hasta obtener una película delgada.
9. Dejar secar el extendido a temperatura ambiente durante 1 hora.
Читать дальше