Cholesterin ist kein Substrat, aus dem wir Energie gewinnen. Cholesterin gehört chemisch zu den Lipiden, zur Gruppe der Sterine. Es ist ein Baustoff für alle Membranen im Körper: den Myelinscheiden der Nervenzellen, Hormone, Gallensäuren und Lipoproteine. Wir synthetisieren und recyceln Cholesterin. Und nehmen es aus der Nahrung auf. Wir haben kein System, das Cholesterin abbaut. Wir scheiden den Überschuss aus.
Die Membranen von eukaryotischen Zellen sind im Grundbau gleich. Eine Doppelschicht aus Phospholipiden (Fette mit einer Phosphatgruppe) bildet eine wasserundurchlässige Hülle. Cholesterin festigt die Membranen und schafft Zonen mit unterschiedlichen Dichten, die den Transfer von Molekülen regeln. Diese Cholesterinflöße ( rafts ) wirken wie Treffpunkte für Membranproteine. Ein Beispiel sind die Untereinheiten des Insulinrezeptors. Diese liegen verstreut in einem solchen Cholesterinfloß. Die Bindung von Insulin, initiiert die Montage der Untereinheiten. Fehlt das Cholesterin, bleiben die Untereinheiten solo und das Insulin wirkt nicht. Die Zelle reagiert nicht auf Insulin, sie ist insulinresistent.
Eine andere Aufgabe des Cholesterins ist die Synthese von Hormonen. Cholesterin ist der Baustein für Glukokortikoide (Kortisol und Kortikosteron), für Mineralkortikoide und von Sexualhormonen. In der Haut ist Cholesterin der Ausgangsstoff für Vitamin D.
Aus Cholesterin synthetisiert die Leber Gallensäuren, die Nahrungsfette emulgieren und deren Verdauung erst ermöglichen.
Cholesterin ist ein Baustein von Lipoproteinen, die Triglyceride und Vitamine transportieren und Teil der Immunantwort sind. Alle Lipoproteine enthalten Cholesterin. Das low-density lipoprotein (LDL) beinhaltet den größten prozentualen Anteil an Cholesterin, rund 50 %. Gesamtcholesterin schließt das Cholesterin aller Lipoproteine ein. Davon sind rund Zweidrittel LDL (Abb. 2).
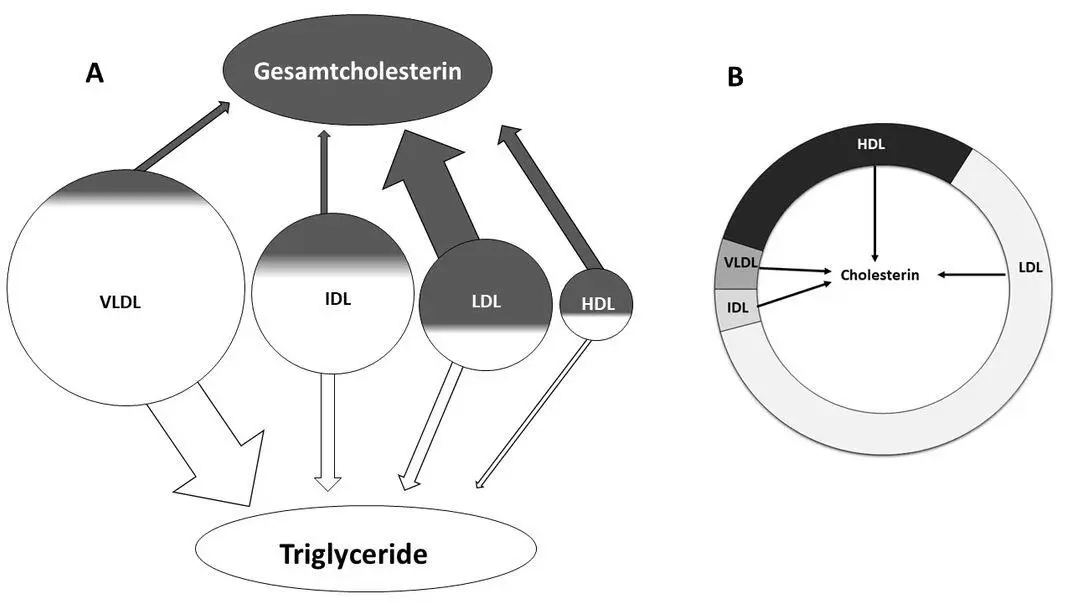
Abb. 2 Triglyceride und Gesamtcholesterin setzen sich aus den TG und Cholesterin aller Lipoproteine zusammen.
Wenn der Körper mehr Fett verstoffwechselt, steigt der Verkehr an Lipoproteinen. Wie beim Fasten oder in der ketogenen Ernährung. Das Gesamtcholesterin und konsequenterweise das LDL nehmen innerhalb von Tagen zu. (3) Eine Fastenstudie an zehn Menschen ohne Übergewicht berichtete, dass das Cholesterin von durchschnittlich 114 mg/dl auf 189 mg/dl anstieg. Ein Zuwachs von 66 % innerhalb einer Woche. (4) Bei Menschen mit Übergewicht scheint das Gegenteil der Fall zu sein: Das Cholesterin sinkt. (5) Fasten erhöht das LDL und dasselbe gilt für die ketogene Ernährung.
Cholesterin ist ein essenzielles Molekül. Einen Kampf gegen Cholesterin empfände ich als eine Verachtung meines eigenen Körpers.
Quellenangaben
1. Dietschy JM. Central nervous system: cholesterol turnover, brain development and neurodegeneration. Biol Chem. 2009 Apr;390(4):287-93.
2. Berghoff SA, Gerndt N, Winchenbach J, Stumpf SK, Hosang L, Odoardi F, Ruhwedel T, Böhler C, Barrette B, Stassart R, Liebetanz D, Dibaj P, Möbius W, Edgar JM, Saher G. Dietary cholesterol promotes repair of demyelinated lesions in the adult brain. Nat Commun. 2017 Jan 24;8:14241.
3. Ende N. Starvation studies with special reference to cholesterol. Am. J. Clin. Nutr. 1962. 11:270-280
4. Sävendahl L, Underwood LE. Fasting increases serum total cholesterol, LDL cholesterol and apolipoprotein B in healthy, nonobese humans. J Nutr. 1999 Nov;129(11):2005-8.
5. Jackson IM. Effect of prolonged starvation on blood lipid levels of obese subjects. Metabolism. 1969 Jan;18(1):13-7.
Lipoproteine – die Transporter
Lipoproteine (LP) sind wie Pralinen: innen weich, außen fest. Ihre Hüllen bestehen aus Fetten gespickt mit Cholesterin und Protein, die den Transport durch das Blut managen. Diese Proteine, die Apo-Proteine, sind das Merkmal der LP, durch die sie an Zielzellen binden.
Im Innern enthalten die LP eine Mischung aus TG, Phospholipiden und Cholesterin. Ihre jeweiligen prozentualen Anteile im LP definieren ihre Aufgaben: Chylomikronen enthalten einen hohen Anteil an TG und wenig Cholesterin. Ihre Aufgabe ist der Transport von TG. LDL enthalten weniger TG und mehr Cholesterin. Ihre Aufgabe ist der Transport von Cholesterin.
Im Folgenden beschreibe ich knapp den Aufbau und die Funktion jedes Lipoproteins, bevor ich mich der Atherosklerose zuwende.
Chylomikronen
Die Chylomikronen sind der erste Schritt in der Verteilung des Nahrungsfetts im Körper. Diese LP haben einen Durchmesser von rund 1000 Nanometer (nm) und einen TG-Gehalt von bis zu 90 %. Darmzellen synthetisieren und beladen Chylomikronen mit Fetten (Lipidierung). Von hier aus treten sie zuerst in die Lymphe ein und dann ins Blut. Die Chylomikronen docken an Zielzellen an und geben den Großteil der TG ab. Ihr Durchmesser schrumpft auf ca. 150 nm. Sie kehren als Chylomikron-Reste ( chylomicron remnants ) zur Leber zurück. Ihre Füllung hat sich in ihrer Zusammensetzung nicht verändert: rund 90 % Fette und wenig Cholesterin. Die Leber recycelt die Chylomikron-Reste.
Fett ist der Hauptenergieträger der ketogenen Ernährung. Die tägliche Aufnahme von Fett ist entsprechend hoch. Chylomikronen verteilen die erste Runde von Fett in den Körper. Ihr Anteil im Blut ist höher als bei einer fettarmen Ernährung. (1)
VLDL und LDL
Die Chylomikronen transportieren die erste Runde Fette zum Zielgewebe. Zurück kehren sie als Chylomikron-Reste, die verbleibendes Fett zur Leber transportieren. Hier werden die Triglyceride für die zweite Runde in very-low-density lipoproteins (VLDL) verpackt. Der Durchmesser der VLDL liegt zwischen 30 nm und 90 nm und ihre Füllung enthält rund 60 % TG. Sie enthalten dreimal mehr Cholesterin als Chylomikronen. VLDL erfüllen ähnliche Aufgaben wie Chylomikronen: den Transport von Fetten. Der Unterschied ist, dass die TG nicht aus dem Essen stammen, sondern aus der Leber.
Der TG-Vorrat der Leber hat drei Zuflüsse: aus überschüssigen Kohlenhydraten, aus Chylomikronen-Resten und aus mittelkettigen Fettsäuren. Diese sind weniger affin für Chylomikronen und transferieren aus dem Darm direkt in die Leber. In der Leber schlagen TG drei Wege ein: Sie werden oxidiert, sie werden zu Ketonen oder zu VLDL (Abb. 3).
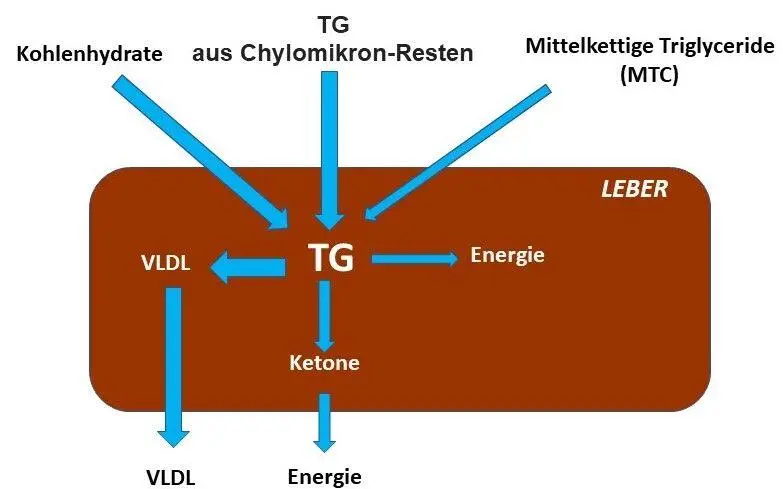
Abb. 3 Ursprung und Schicksal von Triglyceriden in der Leber.
VLDL docken an Zielzellen an, wo Enzyme ihre TG-Ladung löschen. Die Zielzellen nehmen die Fettsäuren auf und oxidieren sie zu Energie oder lagern sie intrazellulär ein.
Leere VLDL werden low-density-lipoproteins (LDL) genannt. Sie enthalten rund 13 % TG und rund 50 % Cholesterin. Ihr Durchmesser ist zwischen 20 nm und 25 nm. Befreit von ihrer TG-Ladung, liefern die LDL das Cholesterin zu allen Organen des Körpers. Ausnahme ist das Gehirn, das sein eigenes Cholesterin synthetisiert. Zellen bekommen Fett und Cholesterin in zeitlich versetzten Stufen. Zuerst das Fett in Chylomikronen und VLDL, anschließend das Cholesterin in LDL.
Die Leber resorbiert und recycelt den Großteil, rund 70 %, der LDL-Partikel. Die anderen Organe bekommen den Rest. Damit das Cholesterol in den Zellen ankommt, binden die LDL zuerst an ihrem Rezeptor (LDLR). Nach der Aufnahme baut die Zelle das LDL ab und setzt das Cholesterin frei. Der LDLR gelangt wieder an die Zelloberfläche (Abb. 4 und Abb. 5).
Читать дальше














