Aunque, según el artículo 9, los requisitos sean menores en las solicitudes presentadas para uso exclusivo en casos de urgencia, en la práctica estos requerimientos se presentan cumpliendo los requisitos establecidos en el artículo 8 del mismo decreto. Además, a diferencia de las solicitudes de autorización de importación para un paciente, los requerimientos para más de un paciente no puede radicarlos una persona natural; en este caso, lo podrá realizar cualquier entidad pública o privada que se encuentre legalmente constituida, en atención a los requisitos dispuestos en el artículo 10.
En el 2013 el Invima emitió la circular dg-100-00022-13, “Autorización de importación de medicamentos vitales no disponibles para más de un paciente”. En esta se aclara cuál es el propósito de las solicitudes para más de un paciente y se resalta que el Invima puede ejercer acciones de inspección, vigilancia y control, por lo que los importadores deben conservar la información y documentación sobre la importación, la comercialización y la distribución de los medicamentos vitales no disponibles, tales como:
• listado de pacientes o criterios identificadores del grupo de pacientes;
• ciudad en que se ubican los pacientes;
• instituciones prestadoras de servicios de salud (IPS) que atienden los pacientes;
• datos de médico tratante;
• demás información que permita la trazabilidad.
En esta línea de discusión, a partir del año 2016 el Invima solicita como requisito adicional en las tres modalidades, el identificador único del medicamento (IUM) reglamentado en la Resolución 3166 de 2015, “por medio de la cual se define y se implementa el estándar de datos para medicamentos de uso humano en Colombia”. En complemento, el 29 de diciembre del 2018, el Ministerio de Salud y Protección Social y el Ministerio de Comercio, Industria y Turismo emitieron el Decreto 2498 de 2018, “por el cual se determina la permanencia de un reglamento técnico en materia de medicamentos vitales no disponibles en el país”. De esta manera, la publicación se realiza en atención al artículo 2.2.1.7.6.7 del Decreto 1074 de 2015, “por medio del cual se expide el Decreto Único Reglamentario del Sector Comercio, Industria y Turismo”. En este documento se exige una revisión por parte de la entidad regulatoria de las normas emitidas, con el fin de determinar su permanencia, modificación o derogatoria, al menos una vez cada cinco años, y así verificar si existe algún cambio conforme a las causas que dieron origen a la norma (Decreto 1074, 2015).
En este decreto también se determina la permanencia del reglamento técnico para el Decreto 481 de 2004, lo cual denota que no se requiere ningún tipo de modificación porque la salud pública del país, en lo que concierne a la importación y comercialización de medicamentos vitales no disponibles, no ha cambiado en catorce años o, sencillamente, se advierte que no se dio el espacio propicio para revisar la norma con los diferentes actores involucrados.
Aunque en el decreto señalado no se estipula qué dependencia debe realizar el estudio de las solicitudes de medicamentos vitales no disponibles, es necesario señalar que de acuerdo con el numeral 5 del artículo 23 del Decreto 2078 de 2012, “por el cual se establece la estructura del Instituto Nacional de Vigilancia de Medicamentos y Alimentos-Invima y se determinan las funciones de sus dependencias”, la Dirección de Operaciones Sanitarias es la encargada de tramitar, estudiar y emitir el concepto sanitario sobre licencias y autorizaciones de importación, esto en conformidad con la normatividad vigente. Por tanto, estas solicitudes son radicadas ante el Invima y estudiadas por el grupo de autorizaciones y licencias para importación y exportación de la Dirección de Operaciones Sanitarias.
Una vez se reciben las solicitudes de autorización de importaciones, el profesional a cargo del estudio del trámite determina si esta cumple con los requisitos establecidos en el Decreto 481 de 2004, acorde al tipo de petición presentada por el interesado y, de modo simultáneo, se verifica si el medicamento está incluido en el listado de medicamentos vitales no disponibles 12. De ser así, el trámite únicamente lo estudia la Dirección de Operaciones, y en caso contrario, esta dependencia requerirá pronunciamiento de la Dirección de Medicamentos y Productos Biológicos. Luego del análisis, al margen de los dos casos, el grupo de autorizaciones determina si la solicitud se puede autorizar, negar o si se necesita información adicional para continuar con el estudio (Invima, 2018). En consecuencia, a corte del 2019 había un total de 249 medicamentos incluidos en el listado de medicamentos vitales no disponibles.
En el caso de que una solicitud requiera información adicional, el solicitante cuenta con treinta días calendario, prorrogables, para presentar la respuesta ante la dependencia encargada del estudio, según lo establecido en el Código de Procedimiento Administrativo y de lo Contencioso Administrativo (Ley 1437, 2011). Así, el solicitante puede o no presentar respuesta satisfactoria y, dependiendo de esto, se determina si se autoriza o se niega la solicitud. Es importante indicar que en ocasiones los interesados desisten o abandonan su pretensión. En estos casos se genera una resolución de negación por desistimiento expreso o tácito según corresponda (Invima, 2018).
En el diagrama de flujo de la figura 1se detalla el proceso de autorización de importación de medicamentos vitales no disponibles.
FIGURA 1. Solicitudes de medicamentos vitales no disponibles
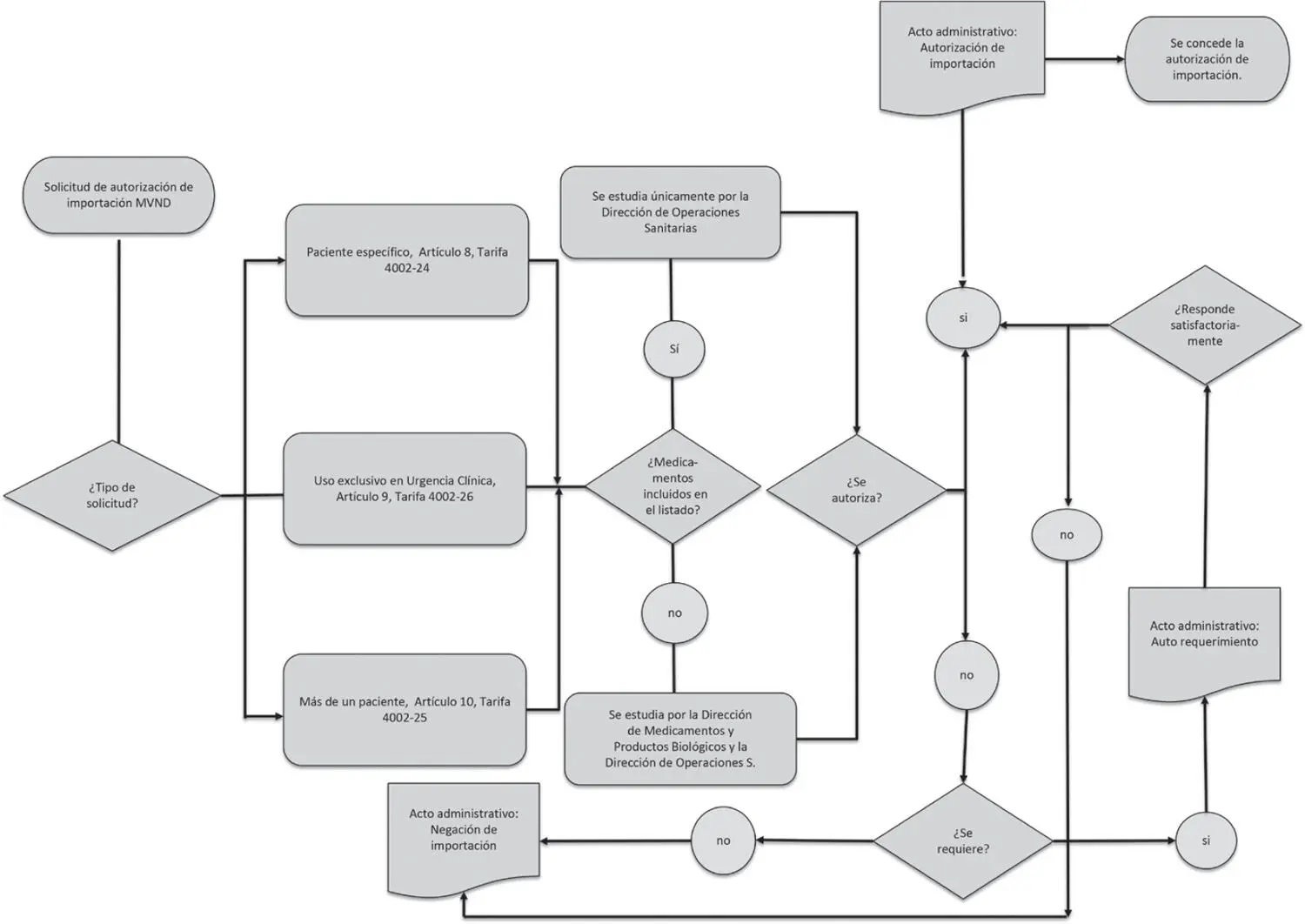
Fuente: elaboración propia.
Ahora bien, las autorizaciones concedidas deben ser presentadas ante la ventanilla única de comercio exterior (VUCE). El interesado debe cumplir diligenciando la licencia de importación acorde con lo establecido en la guía de diligenciamiento de intenciones de importación ante la VUCE, disponible en la página web del Invima (2019).
Según lo estipulado por el artículo 15 de la Ley Estatutaria de Salud (Ley 1751, 2015), el sistema de salud no cubre tecnologías en salud si no existe evidencia científica acerca de su seguridad y eficacia clínica, o sobre su efectividad clínica. No obstante, el parágrafo tercero del mismo artículo establece: “Bajo ninguna circunstancia deberá entenderse que los criterios de exclusión definidos en el presente artículo, afectarán el acceso a tratamientos a las personas que sufren enfermedades raras o huérfanas”. Aunque algunos medicamentos para enfermedades raras se encuentran incluidos en el Plan de Beneficios con cargo a la unidad de pago por capitación (UPC) 13, en el caso en el que el paciente requiera un medicamento no incluido, el médico debe hacer la prescripción por el sistema Mipres 14(Minsalud, 2017). Además, en caso de ser autorizado el medicamento o haberse obtenido por orden judicial, lo financia la Administradora de los Recursos del Sistema General de Seguridad Social en Salud (Ley 1955, 2019). En lo que respecta al régimen de exceptuados y/o especiales (Fuerzas Armadas, universidades, magisterio y demás) y quienes no hacen parte del sgsss, la financiación viene de los recursos de cada régimen (Vargas-Peláez et al., 2019).
Análisis comparativo de las legislaciones sobre medicamentos huérfanos o vitales no disponibles de los países incluidos en el estudio
Una vez revisadas las normas a nivel internacional y nacional, en la tabla 3se establecen las diferencias y semejanzas que existen en la legislación colombiana con respecto a las estructuradas en las agencias sanitarias mencionadas (EMA, AEMPS, FDA, Cofrepris, ANMAT, ISP, Invima).
Читать дальше