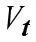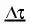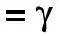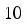Зависимость скорости химических реакций от концентрации (закон действующих масс)
В 1877 г. Гульберг и Вааге на экспериментах и теоретичес-ком изучении зависимости скорости реакций от концентрации сформулировали закон действия масс.
Скорость химических реакций пропорциональна концентрации реагирующих веществ.
Рассмотрим химическую реакцию следующего вида:
А + В → АВ
Из теории вероятности: вероятность сложного события рав-на произведению вероятностей простых событий
V = γ • WA • WB; WA = α • CA; WB = β • CB
γ – постоянная характеризующая среду, в которой происхо-дит взаимодействие.
Чем больше С, тем больше вероятность столкновения моле-кул исходного реагента А в данной точке объема.
Значит: V = γ • β • • CA • CB → V = k • CA • CB, k – константа скорости химической реакции. Физический смысл К: скорость
химической реакции при единичной концентрации.
Если принять С вещества А и В за единичную (1 моль/литр), то тогда константа скорости химических реакций представляет собой скорость химических реакций при единичном значении концентрации.
k – молекулярная характеристика химического процесса, зависит от:
природы реагирующих веществ;
природы полярности растворителя;
от температуры;
но не зависит от концентрации.
При написании уравнения скорость химических реакций учитывают изменение концентрации только лишь газообразных и жидких продуктов реакции.
В том случае когда взаимодействие происходит на поверхности раздела фаз, концентрация твердой фазы считается неизменяю-щейся, постоянной, и не входит в уравнение скорости химической реакции.
Пример: Na2O(тв.) + СO2(2) → Na2CO3(тв.)
V = k • CCO2
Рассмотрит в общем случае взаимодействие нескольких реа-гентов в cоответствии со следующим уравнением реакции:
α A + β B + γ C → dD + eE + …
V = K • CAα • CBβ • CCγ
Для определения скорости реакций сложного многоступенчатого процесса в соответствии с теорией соударений следует предполагать, что V зависит от концентрации реагирующих веществ с показателями степеней, равными их стехиометрическим коэффициентам. Однако, в действительности, вероятность столкновения 3-х и более частиц в одной точке пространства мала.
Механизмы реальных реакций являются сложными, В соответствии с этим постановка показателя степени стехиометрических коэффициентов реакции неправомерна.
На практике для определения кинетических параметров, определяются значения концентрации некоторых реагентов. Сумма показателей кинетических коэффициентов для уравне-ния скорости химических реакций определяет порядок реак-ции. Однако в химии встречаются реакции нулевого, первого, второго и значительно реже – третьего порядка. Порядок реакции может быть дробным, что определяется механизмом реакции.
В химической кинетике важным является понятие молеку-лярности реакции. Под молекулярностью реакции понимают количество молекул, участвующих в элементарном акте процесса. В зависимости от этого различают мономолекулярные реакции, когда в элементарном акте химического процесса участвует 1 молекула (процесс разложения). Димолекулярные реакции, когда в химическом процессе участвуют две молекулы. Тримолекулярные реакции, когда в элементарном акте участвуют 3 молекулы. Эти химические реакции являются до-
статочно редкими. Реакций с более высокой молекулярностью не встречается.
Зависимость скорости химических реакций от температуры
Впервые Вант-Гофф экспериментально показал, что нагре-вание на 10°С дает увеличение скорости химических реакций в
2-4 раза, т.е.
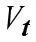
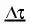

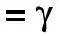
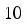
,
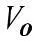
где γ – коэффициент Вант-Гоффа, равен 2 ÷ -4 Показатель степени – число температурных скачков по 10° Кинетическая энергия равна
Ek = mV2/2 = 3/2 KT
где К – постоянная Больцмана, Т – абсолютная температура
при нагреве на 10°.
mV12/2 = 3/2 KT1
= 3/2 K • 273
V
mV22/2 = 3/2 KT2
= 3/2 K • 283
2/V 2 = 283/273 = 1,04; V
/V = 1,02
2
1
2
1
Таким образом, при увеличении температуры на 10° скорость химических реакций увеличивается на 2 %, а не на 200-400, как это следует из уравнения Вант-Гоффа.
Ответ на этот вопрос был впервые дан Аррениусом. Он предположил, что не все соударения приводят к образованию продуктов реакций, а существуют так называемые активные соударения.
Читать дальше
Конец ознакомительного отрывка
Купить книгу