При Р = const: Qp = U +p V = (U2 –U1 ) + p(V2 – V1)
Qp = (U2 – pV2) – (U1 + pV1), где U + pV = H – энтальпия
ΔH – представляет собой функцию состояния вещества, называемого энтальпией и характеризует теплосодержание сис-
темы .
Qp = H2 – H1 = H
Тепловой эффект реакции для процессов, происходит при V
const, равен изменению внутренней энергии (т.к. ΔV = 0).
При V= const: Qv = U
настоящее время наряду с существовавшей ранее термохимической шкалой широко используется термодинамическая шкала, которая учитывает изменение внутренней энергии системы, т.е. если внутренняя энергия системы повышается (эндотермический процесс), то значит изменение энтальпии положительно, т.е. Н>0. Если внутренняя энергия уменьшается (экзотермический процесс), Н<0.
термохимической и термодинамической шкале знаки противоположны. Для проведения различных термохимических расчетов используют стандартные значения энтальпии или
стандартное изменение энтальпии ( H°, H°298 ). Стандартные условия: концентрация 1 моль/ л, р = 101,3 Кпа, Т = 298 K
Основные законы термохимии:
Первый в термохимии закон был сформулирован одновременно двумя исследованиями двух ученых и называется законом Лавуазье–Лапласа.
Тепловой эффект образовавшегося химического соединения равен тепловому эффекту его разложения, но с обратным знаком.
Теплотой образования химического соединения называется изменение энтальпии при образовании 1 моль химического соединения из элементов
Са(тв) + С(тв) + 1,5 О2(г) = CaCO3 (тв)
Н°298 = -1207 кДж/моль
Другой важной характеристикой термохимических величин является теплота сгорания химического соединения. Теплота сгорания представляет собой изменение энтальпии при полном окислении 1 моля химического соединения.
С 6H 6(ж.) + 7,5 O2(г) = 6СО 2(г) + 3Н 2О(ж);
Н°298 =-3280 кДж/моль.
Энтальпии химических соединений (стандартное значение) обычно определяют экспериментально или вычисляют в соответствии со II законом термохимии.
Закон Гесса:
Тепловой эффект реакций зависит только от начального и конечного состояния системы, но не зависит от пути протекания реакций.
C(т.) + О2(г.) → СО2
H = H1
+ H2
1)
(г.)
Н°298
= -393,5 кДж/моль
2)
C(г.) + 0,5О2(г.) → СО(г.)
Н°298
= -110,5 кДж/моль
2(г.) → СО2(г.) Н°298 = -283 кДж/моль
= 2) + 3) = -393,5 = -110,5 + (-283,0)
помощью закона Гесса возможно определение тепловых эффектов реакций и теплот образования химических соединений в тех случаях, когда проведение таких процессов или получение веществ в силу различных причин невозможно.
Из закона Гесса вытекают 2 следствия:
теплота образования химического соединения не зависит от способа его получения;
стандартный тепловой эффект реакции равен сумме стан-дартных теплот образования конечных продуктов за вычетом стандартных теплот образования исходных продуктов.3)CО(г.)+0,5О
Направленность химических процессов
В химии известны процессы самопроизвольно вытекающие при нормальных условиях
O3 = O2 + O
Na2O + CO2 = Na2CO3
Zi2O + CO2 = Zi2CO3
CaO + H2O = Ca(OH)2
2H2O2 → 2H2O + O2
В этих случаях могут протекать химические реакции, и возможно устойчивое состояние молекул дает эмпирический принцип Бертло;
Все химические системы стремятся сократить запас внутренней энергии до минимального значения
Существование озона и перекиси водорода представляют как ложно равновесные системы, поскольку O2 и H2O обладают минимальными затратами энергии. Однако для того, чтобы началось разложение этих веществ в сторону образования более устойчивых молекул, нужно подвести энергию извне, задать энергию активации.
Однако принцип Бертло выполняется не во всех случаях. Известны реакции, для которых процессы взаимодействия происходят с повышением внутренней энергии.
H2 + J2 ↔ 2HJ; H°298 = 6 кДж/моль
Кроме того, при высоких температурах начинают проходить реакции, которые запрещены принципом Бертло.
4. Микросостояние системы оценивается параметрами отдельных частиц. Макро состояние системы оценивается усредненными параметрами этих частиц
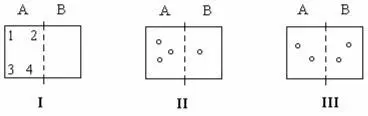
I
II
III
A
B
A
B
A
B
1, 2, 3, 4
, 2, 3
4
1,2
3,4
, 2, 4
3
1,3
2,4
, 3, 4
2
1,4
2,3
, 3, 4
1
2,3
1,4
,4
1,3
,4
1,2
Таким образом, в результате возможного распределения частиц: для 1 макросостояния системы реализуется только одно состояние микросистемы; II макро состояние описывается четырьмя состояниями; III макросостояние соответствует 6 микросостояниям.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













