разуются тетраэдрически построенные в пространстве 4 связи.
CH4

Итак, строение молекул линейное, плоскостное или тетра-эдрическое определяется направлением гибридной орбитали в пространстве.
При гибридизации р и d орбиталей, d и f орбитали образу-ют более сложные гибридные орбитали. Однако следует иметь ввиду, что гибридизация возникает всегда, когда в образовании химических связей участвуют орбитали различных типов.
ОБМЕННЫЙ И ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ
В рамках метода валентных связей образованные общие электронные пары возможны по обменному или донорно–ак-
цепторному механизму, например:
A· + -B → A ÷ B (обменный механизм)
A + :B → A : B (донорно-акцепторный механизм) А – донор электронов; В – акцептор электронов Акцептор представляет свободную орбиталь.
H

H+
|
|
H – N + :H +—
H – N – H -ион аммония
|
|
H
H
Донор отдает неподеленную электронную пару (азот).
Недостатки метода валентной связи
Если рассмотреть строение таких простых ионов, как Н2+, Не+ то видно, что химическая связь в них образована нечетным количеством электронов. Свойства таких простых соединений, как СО, NO, также не могут быть объяснены с помощью метода ВС.
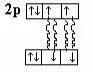
Для молекул O2, исходя из его электронной конфигурации следовало ожидать при внесении в постоянное магнитное поле наличие диамагнитных свойств. В действительности же, O2 обладает парамагнитными свойствами.
8O 1S22S22P4
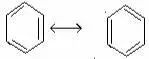
Для органических, в особенности для напряженных ароматических соединений этот метод является громоздким и потребовал для описания свойств введения большего числа гипотетических электронных структур (т.н. канонических структур) (см. теорию резонанса Полинга).
структура Тиле
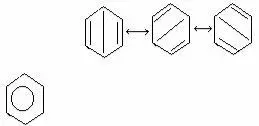
Дьюар
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (МО)
Метод МО впервые был сформулирован в работе Хьюккеля и Малликена и выведен из положений квантовой механики. Основным является уравнение Шредингера, которое записывается в следующем виде:
H • ψ = E • ψ,
H – оператор, который включает в себя кинетическую и потенциальную энергию ядер, электронов, энергию взаимодействия электронов между собой, ядер между собой и электронов с ядрами; ψ – молекулярная волновая функция (строится из атомных волновых функций и представляет собой аналогию с амплитудой стоячей волны; E – полная энергия молекулы.
настоящее время точное решение уравнения Шредингера
общем виде в случае многочастичного взаимодействия практически невозможно. Однако, решение это становится возможным для валентных электронов, которые определяют совокупность химических свойств.
Предположим, что молекулярная волновая функция представляет собой линейную комбинацию атомных волновых
функций, т.е.
ψ = С1ψ1 + С2 ψ2 + … + Сn ψn ,
где ψ1, ψ2, ψn – атомные волновые функции; C1, C2, Cn – ко-
эффициент, характеризующий вероятности нахождения элек-трона около ядер 1, 2 или n.
Основные положения метода МО сводятся к следующему:
в молекуле все электроны являются общими, т.е. размещены в
пространстве между ядрами;
каждому электрону могут быть приписаны в соответствии с решением уравнения Шредингера определенные значения энергий, т.е. молекулярные орбитали, обладающие определенным значением энергии;
силы взаимодействующие при образовании химической свя-зи являются электростатическими;
в соответствии с принципом Паули на каждой новой образующейся МО располагается только 2 электрона, с взаимно компенсированными спинами;
порядок заполнения электронов МО определяется значением энергий МО; раньше заполняются те МО, которые имеют меньшие значения энергии.
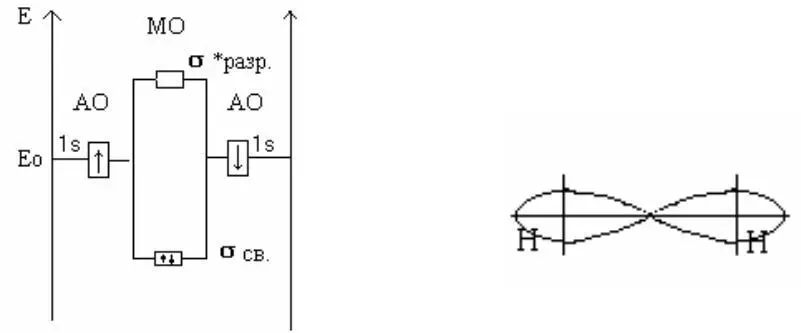
σ разр.* – разрыхляющая МО
Читать дальше
Конец ознакомительного отрывка
Купить книгу