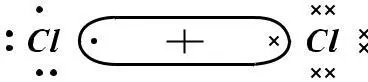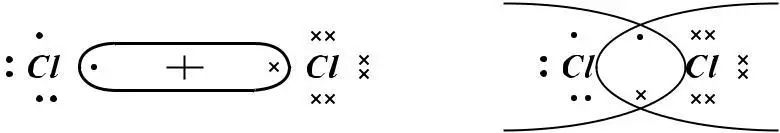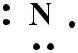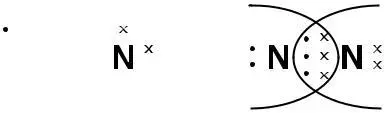Однако, не все химические соединения можно объяснить с позиций этой теории: H 2, Cl 2и т.д. (H +,H –). Органические соединения также не укладывались в рамки этой теории.
Теории, базирующиеся на электронном строении были предложены Косселем и Льюисом.
Положения. При формировании электронных оболочек в конце каждого периода реализуется устойчивая s2 и s2p6 кон-фигурация, поэтому атомы стремятся создать устойчивые 2-х или 8-и электронные оболочки.
ТЕОРИЯ КОССЕЛЯ
Застройка внешнего ē слоя до двух или восьмиэлектронной конфигурации может происходить двумя способами:
а) путем присоединения электронов б) путем отдачи электронов
а) 11Na 1s22s22p63s1
Na0 – ē → Na+[1s22s22p6(Ne)]
б) 17Cl 1s22s22p63s23p5
Cl0 +ē → Cl-[1s22s22p63s23p6(Ar)]
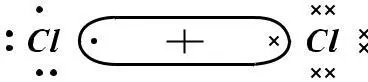
Процесс образования химической связи заключается в передаче электронов от атома Na к атому Cl, в результате чего образуются разноименно заряженные ионы, связанные между собой силами электростатического взаимодействия. Такая связь получила название ионной (гетерополярной) или электровалентной.
Недостаток теории в невозможности объяснения связи в органических соединениях, а также в молекулах H2, Cl2 и т.д.
ТЕОРИЯ ЛЬЮИСА
Основным положением теории Льюиса является то, что образование химической связи до устойчивой 2-х или 8-элект-ронной оболочки осуществляется путем обобществления электронов.
1) Cl2 17Cl 1S22S22P6 3S23P5
Символом элемента обозначим ядро атома с внутренними электронами, внешние валентные электроны – точками.
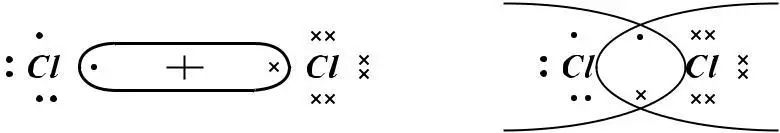
(Cl–Cl)
Рассмотрим образование химической связи для молекулы N2



7N 1S22S22P3
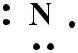
2P3 Px Py Pz

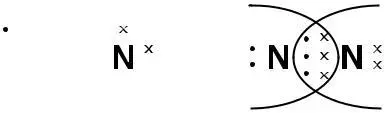
(N ≡ N )

Такая связь, образовавшаяся путем обобществления электронов, называется ковалентной или гомеополярной или атомной.
В том случае, когда химическое соединение или молекула состоят из одинаковых атомов образуется неполярная ковалентная химическая связь.
При образовании молекул, состоящих из разных атомов, образуется ковалентная полярная связь, причем электронные пары смещаются в сторону более электроотрицательного атома. Для оценки полярной химической связи вводится величина дипольного момента, чем больше значение его, тем больше полярность связи ядрами. В результате проведенного расчета было установлено, что образование ковалентной химической связи возможно только лишь в том случае, если спины электронов ориентированы противоположно, т.е. ковалентная химическая связь представляет собой 2-х центровую, 2-х-электронную химическую связь с различной ориентацией спинов.
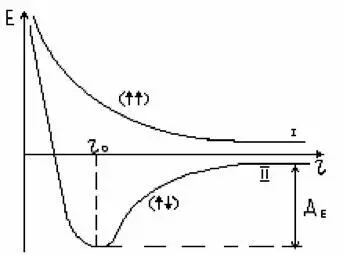
Е – энергия системы,
r – расстояние между ядрами, ДЕ – энергия диссоциации молекул Н, которую условно можно считать энергией образующейся химической связи
В случае кривой оси (I) не происходит образования химических связей. В случае противоположном (II) наблюдается образование минимума полной энергии, что свидетельствует об образовании ковалентной химической связи. r0 представляет собой межъядерное расстояние. Данный метод был распространен на различные химические соединения: органические, неорганические, комплексные соединения. Метод валентных связей является наглядным поскольку электронная пара может быть представлена в виде черты (валентность).
Читать дальше
Конец ознакомительного отрывка
Купить книгу