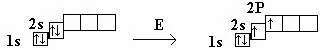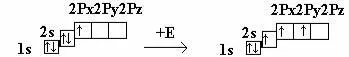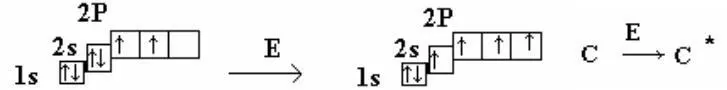
Многие свойства химических соединений объ-ясняются методом валентных связей, однако метод ВС не объясняет существование, напри-мер, ионов (Н 2 +) или молекул СО, NO
ВОЗБУЖДЕННЫЕ ВАЛЕНТНОСТИ АТОМОВ
Известно, что многие элементы способны участвовать в образовании нескольких типов химически связей. Это происходит при возбуждении атома и при переходе электрона на сво-бодные вакантные орбитали (p, d, f ).
При столкновении двух атомов Cl c различными ориентациями спинов ē происходит образование соединений с вален-тностью, равной 1.
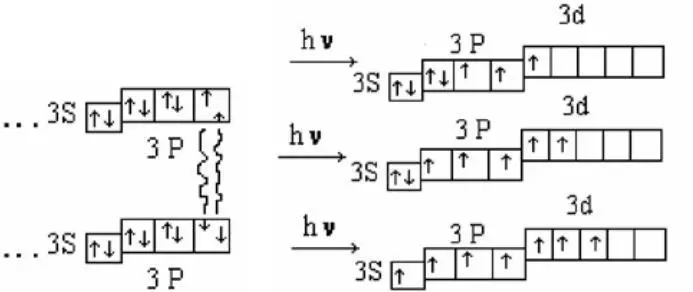
Таким образом, в рамках метода валентных связей и объясняется возможность образования возбужденных валентностей атомов Cl. По этой же схеме происходит образование возбужденных состояний других атомов.
НАСЫЩАЕМОСТЬ И НАПРАВЛЕННОСТЬ СВЯЗЕЙ В
ПРОСТРАНСТВЕ
Важным свойством химических связей является ее насыщаемость и направление в пространстве, что характеризует строение молекулы. Насыщение химических связей объясняется с позиций запрета Паули. Направление химических связей объ-
ясняется пространственной ориентацией электронных атомных орбиталей. В зависимости от ориентации атомных орбиталей происходит условное деление на орбитали σ и π
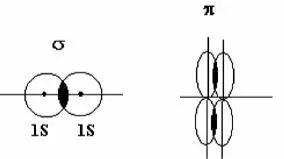
Условное обозначение выбирается относительно элементов симметрии. Если элементом симметрии является ось симметрии, такая связь называется σ-связью. Если элементы симметрии – плоскость, то такая связь получила название π-связи.
H 2O NH 3
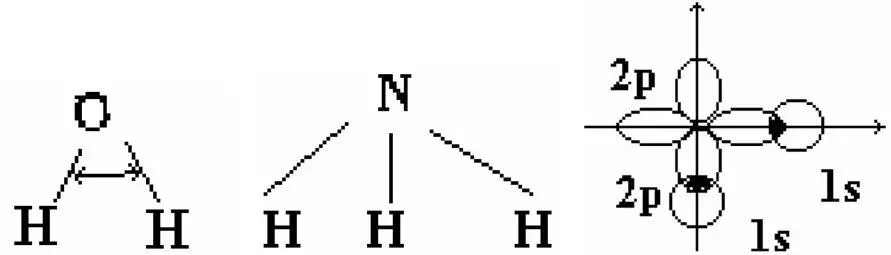

HOH = 104°3

HNH = 107°

HOH =104° 30'
Следовало ожидать, что значение валентных углов для этих молекул должны быть равны 90°. Однако, экспериментальные данные показали, что значения этих углов равны (см. выше). Объяснение этого расхождения впервые было получено Поли-нгом введением гипотезы гибридизации.
ГИБРИДИЗАЦИЯ ОРБИТАЛЕЙ
Рассмотрение понятия гибридизации орбиталей, лучше всего понять на примере: бериллия, бора, углерода
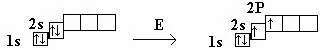
4Be 1S22S2
Be → Be*
ΔΕ = 323 кДж/моль
Атом Be, поглощая энергию, переходит в возбужденное состояние. При образовании химических связей происходит смешивание по форме и энергии электронных орбиталей. В результате об-разуется смешанная (гибридная) электронная орбиталь.
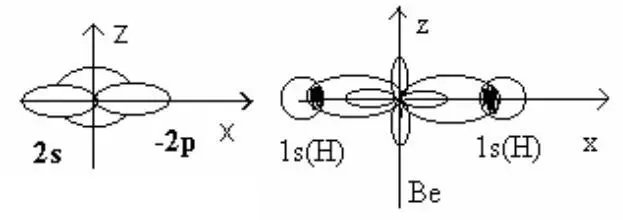
Произошло образование новой sp –гибридной орбитали.
При смешивании по форме и энергии двух орбиталей s– и p-типа наблюдается выигрыш в энергии, т.е. понижение энергии по сравнению с s– и р-орбиталями.
При образовании химических связей между s– и p-гибрид-ными орбиталями и 1 S орбиталями для атома Н в случае обра-зования гибрида ВеН 2вероятность перекрывания электронных орбиталей также увеличивается, что проводит к дальнейшему понижению энергии. Таким образом, при гибридизации и при образовании химических связей, энергия возбуждения компенсируется; общая энергия возбуждения молекул становится меньше по сравнению с энергией изолированных атомов на величину энергии химической связи.
ПРОСТРАНСТВЕННАЯ ОРИЕНТАЦИЯ
Пространственное направление гибридных sp-орбиталей та-ково, что в результате образуется линейная структура молекулы.
5B 1s22s22p1
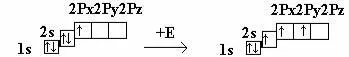
sp2 -гибридизация
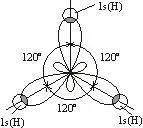
три Sp2 -гибридизационных атомных орбит образуют плоскостную структуру
молекулы BH3 (плоский треугольник).
6C 1s22s22p2
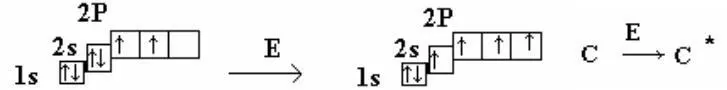
∆E = 400 кДЖ/моль
При взаимодействии одной 2s орбитали с 3-мя 2p-орбиталями происходит образование четырех новых sp3-гибридных орбита-лей, расположенных друг относительно друга под углом 109°28’. Ориентированы орбитали из центра тетраэдра по его углам. Об-
Читать дальше
Конец ознакомительного отрывка
Купить книгу