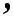Как показано на рис., на оси ординат количество молекул, обладающих определенной энергией столкновения, на оси абсцисс – энергия соударения. При температуре Т, активными яв-ляются такие молекулы, для которых энергия соударения много больше энергии Eа, получившей название энергии активации.
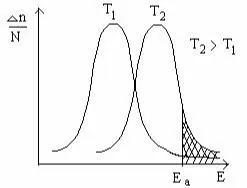
Для температуры Т2 эта зависимость аналогична. В этом слу-чае резко возрастает количество активных молекул, что в конечном итоге к приводит к увеличению скоростей химических реакций, Аррениус на основании теоретических и эксперимен-тальных данных показал, что постоянная скорости химических реакций зависит от температуры и определяется по уравнению:
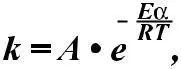
где – А – фактор соударений, характеризующий частоту активных соударений; е – основание натурального логариф-ма = 2.71, Еа – энергия активации, R – газовая постоянная, T – абсолютная температура.
На основании этого уравнения с высокой степенью точнос-ти можно определить константу k, а следовательно и саму V. Однако, не для всех случаев соблюдается совпадение теорети-ческих значений константы скорости химическиx реакций с экспериментальным определением.
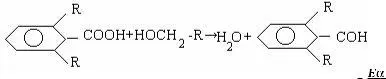
где Р – стерический фактор, Р ≤ 1 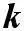
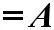

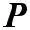

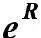
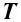 В этом уравнений Р – стерический фактор учитывает объем
В этом уравнений Р – стерический фактор учитывает объем
заместителей в реагирующих молекулах. Чем больше заместитель, тем меньше становится вероятность атаки реакционного центра, тем больше наблюдается расхождений между расчетными и экспериментальными значениями скоростей. Стери-ческии фактор «Р» определяется экспериментально.
Понятие об активированном комплексе (о переходном состоянии)
При взаимодействии реагентов возможны образования различных промежуточных продуктов реакции, причем скорость этих реакций может существенно отличаться. Кроме того, из промежуточных продуктов реакции при столкновении, могут проходить процессы, параллельные основной реакции. Таким образом, все совокупности данных о строении исходных реагентов, промежуточных продуктов реакции и конечных во времени характеризует механизм химической реакции. При изучении механизма химических реакций используются различные экспериментальные и теоретические методы.
В настоящее время наибольшие успехи были получены с помощью теории абсолютных скоростей реакций и теории активированного комплекса. Теория абсолютных скоростей реакции основывается на классической теории взаимодействия двух частиц. В теории активированного комплекса предпола-гается образование на промежуточной стадии так называемого переходного состояния или активизированного комплекса.
H2 + J2 < = > 2HJ
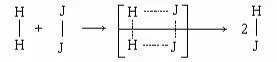
τ = 10– 8 с
При столкновении двух частиц А и В при образовании акти-вированного комплекса, возможно перекрывание электронных оболочек, что приводит к ослаблению старых химических связей
образованию новых химических связей. Образовавшееся таким образом переходное состояние является термодинамическим неустойчивым и возможно разрушение его с образование как исходных реагентов, так и продуктов реакции (см. график). Следует отметить, что не каждое активное столкновение можно привести к образованию активированного комплекса, а только такие со-ударения, при которых осуществляется максимальное перекры-вание электронных оболочек взаимодействующих атомов.
Таким образом, для проведения химического процесса, т.е. для образования активированного состояния, следует затра-
тить необходимое количество энергии, которое получило назва-
ние энергии активации – Ea, которая представляет собой разницу между энергиями образования активированного комплекса
исходных реагентов. Взаимодействие возможно только тогда, когда энергия активных частиц больше или равняется Ea. Однако, известны в химии реакции, сопровождающие образование конечных продуктов без образования переходного состояния (туннельный эффект).
Читать дальше
Конец ознакомительного отрывка
Купить книгу


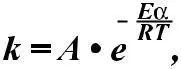
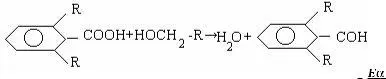
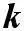
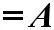

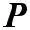
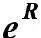
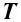 В этом уравнений Р – стерический фактор учитывает объем
В этом уравнений Р – стерический фактор учитывает объем