Зависимость скорости химических реакций от катализатора
Катализатором (К) называется химическое вещество, изменяющее скорость химических реакций. Катализатор, уменьшающий скорость химических реакций, называется ингибитором (И).
Различают гомогенный и гетерогенный катализ. В случае гетерогенного катализатора взаимодействие происходит на по-верхности катализатора, гомогенного – активность вещества определяется в реакционном объеме.
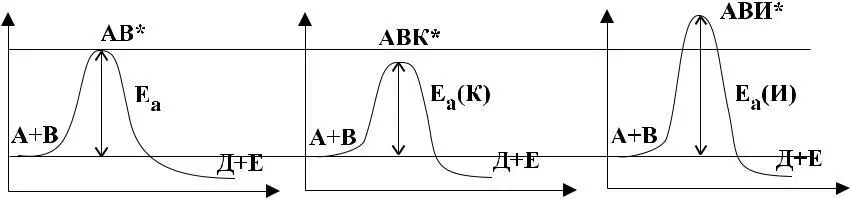
При взаимодействии реагентов в присутствии катализатора, образуется новое переходное состояние, включающее в свою структуру катализатор, В этом случае при повышении скорости химической реакции происходит уменьшение энергии активации (Е), а при применении ингибитора (Е) – увеличивается, по сравнению с (Е) исходных реагентов без применения катализатора. То есть катализатор в переходном состоянии с исходными реагентами образует систему новых химических связей.
Катализаторы обладают избирательным или селективным свойством, что для одних и тех же исходных реагентов приводит к образованию различных продуктов реакции:
C2H5OH T = 300°C
H2O + C2H4
Al2O3
T = 300°C
O
C2H5OH
H2O + CH3 – C
Al2O3
H



В настоящее время не существует единой теории катализа, поэтому в основном в химии при подборе катализатора используются экспериментальные методы. Одним из недостатков этого метода является отравление катализатора. При выборе того или иного катализатора необходимо избавляться от каталитических ядов.
ЛЕКЦИЯ 7.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
План:
Реакции обратимые и необратимые.
Правило Бертолле.
Принцип Ле-Шателье.
В химии известны реакции двух типов:
необратимые химические реакции (идущие до конца).
обратимые химические реакции
К необратимым можно отнести такие реакции, которые со-провождаются выделением газообразных, труднорастворимых или мало диссоциирующих химических соединений.
Ba Cl2 + Na2SO4 → BaSO4↓ + 2NaCl
Zn + HNO3 конц → Zn(NO3)2 + 2NO2↑ + 2H2O
NaOH + HCl → H2O + NaCl
Другие реакции следует отнести к обратимым реакциям. Впервые на обратимые реакции обратил внимание Бертоле при
получении поваренной соли из морской воды
Na2SO4 + MgCl2 <=> 2NaCl + MgSO4
Впервые знак обратимости химический реакций был введен
Вант-Гоффом.
Рассмотрим в общем виде обратимую реакцию:
А + В
V1
C + Д
V 2
V1
= V2
; V1
= k1
= K2 • CC • CД
• CA • CB ; V2
k 1
• CA
• CB = k2 • CС
• C Д
K = k1 /k2
= (CA • CB )/(CС • CД )

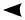
Изменение концентрации исходных реагентов А и В в зави-
симости от времени. Таким образом, химическое равновесие при взаимодействии достигается тогда, когда скорость прямой реакции будет равна скорости обратной.
Такие значения концентрации получили название равновесных концентраций. Константа химического равновесия (K) – равна отношению константы прямой реакции к константе обратной реакции или равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных соединений.
Константа химического равновесия зависит от природы реа
гирующих веществ, природы растворителя, от температуры.
В том случае, когда константа прямой реакции будет изменяться в большей степени в зависимости от температуры, чем константа обратной реакции, то и константа химического равновесия будет увеличиваться с увеличением температуры. Кон-
станта химического равновесия не зависит от исходной концентрации реагирующих веществ.
Константа химического равновесия представляет собой постоянную величину, т.е. имеет фиксированную величину при определенном значении температуры. Катализатор не оказывает влияния на величину К. и не изменяет выход обратимой реакции.
Если К>>1, то равновесие химической реакции практически смещено в сторону образования продуктов, если К<<1, то хи-
мическое равновесие смещено в сторону исходных реагентов.
2С(тв) + O2(2)
K1
2CO(2)
K2
/ [O2]
K. = K1 /K 2 = [CO] 2
При написании уравнений для К. необходимо использовать
Читать дальше
Конец ознакомительного отрывка
Купить книгу