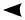значение равновесных концентраций.

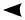
Если же концентрация молекул практически не изменяется (твердые вещества) значение концентрации принимается постоянным и не вводится в уравнение концентрации равновесия.
Смещение химического равновесия. Принцип Ле-Шателье.
Смещение химического равновесия можно достигнуть несколькими путями:
1) изменением температуры. Известно, что константа химического равновесия имеет фиксированное значение при определенной температуре.
Q – 3H2 + N2 <=> 2NH3 + 92 кДж/моль ΔH0298 = -92 кДж/моль
Таким образом, для данного экзотермического процесса охлаждение системы приводит к смещению химического равновесия в сторону образования аммиака. При повышении температуры химическое равновесие системы смещается вправо, поскольку данная реакция является эндотермической.
2) Изменение концентрации.
3KCNS + FeCl3
K1
Fe(CNS)3
+ 3KCl
K2
K =
K
1
=
[Fe(CNS)
3
] • [KCl]3
K
[KCNS]3
]
2
• [FeCl3

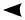
При взаимодействии исходных реагентов образуется ру-биново-красное окрашивание раствора (цвет Fe(CNS)3). При
добавлении к равновесной системе избыточного количества KCNS или FeCl3 видим, что интенсивность окраски воз-растает, т.е. произошло смещение химического равновесия вправо.
При добавлении к равновесной системе избыточного коли-чества KCl интенсивность окраски уменьшается, т.е. равнове-сие сместилось в сторону исходных реагентов.
В 1 случае при постоянном значении константы равновесия происходит изменение (увеличение значения равновесной концентрации в знаменателе уравнения). Эти изменения приводят к увеличению значения равновесной концентрации конечных продуктов реакции.
Во 2 случае происходит увеличение равновесной концентрации в числителе уравнения, что в свою очередь вызывает увеличение равновесной концентрации конечных продуктов, т.е. равновесие смещается в сторону исходных реагентов.
3) В частности, в случае изменения концентрации для процессов, протекающих в газах, значимым является изменение давления
3H2 + N2 < === > 2NH3
Для этих процессов при увеличении давления равновесие смещается в сторону меньшего числа молекул (когда объем ре-агируюших веществ превышает объем образующихся продуктов реакции). В том случае, когда в процессе реакции не происходит изменения объемов, изменение давления не приводит к смещению химического равновесия.
Общий ответ о возможном смещении химического равновесия заключен в эмпирическом принципе Ле Шателье:
Если на систему, находящуюся в равновесии оказать какое-либо внешнее воздействие, то в результате процессов происходящих в ней, химическое равновесие будет смещаться в сторону того процесса, который это воздействие будет уменьшать.
Однако известно, что в тех случаях, когда в процессе реакция образуется легколетучее, малодиссоциируемое или труд-норастворимое вещество, реакции практически происходят до конца.
Впервые данное положение было сформулировано Бертол-
ле:
Если в обратимой реакции образуются легко летучие, мало растворимые или мало диссоциирующие химические соединения, то равновесие смещается в сторону их образования.
Для равновесных процессов ΔG = 0
Из термодинамики известно, что ΔG = – RT • lnK, где К – константа химического равновесия.
Данное уравнение устанавливает связь между изменением свободной энергии Гибса и константой химического равнове-сия. При расчетах используется следующее уравнение:
ΔG = ΔH – TΔS = 0
ΔH = TΔS
TРАВН = ΔH/ΔS
Девиз: РАСТВОР – ХИМИЧЕСКАЯ СИСТЕМА
ЛЕКЦИЯ 8
ОБЩИЕ ЗАКОНОМЕРНОСТИ И СВОЙСТВА
РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
План лекции:
Теории растворов.
Свойства растворов неэлектролитов.
Способы выражения концентрации растворов.
В зависимости от агрегатного состояния вещества различают так называемые 9 дисперсных систем. Если в каком-нибудь веществе (среде) распределяется другое вещество, то такая сис
тема называется дисперсной.
I.
1) Т-Т
2) Т-Ж
3) Т-Г
II.
4)
Ж-Г
5)
Ж-Т
6)
Ж-Ж
III. 7)
Г-Т
8)
Г-Г
9)
Г-Ж
Наиболее важное значение в химии приобретают системы I и II группы т.е. твердые и жидкие растворы. Условно жидкие растворы разделяют на:
1) взвеси (Ø частиц > ммк) : а) суспензия, 6) эмульсия; 2) одно-родные (Ø частиц < 1 мм) (истинные, молекулярные растворы); 3) промежуток между 1) и 2) занимают коллоидные растворы.
Читать дальше
Конец ознакомительного отрывка
Купить книгу