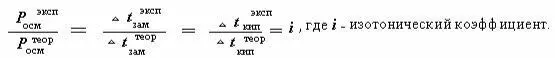Их значение для разбавленных растворов получают для одномоляльных растворов. Т.о. криоскопическя постоянная показывает на сколько одномоляльный раствор затвердевает ниже растворителя, а эбуллиоскопическая – на сколько раствор кипит выше по сравнению с растворителем. Для каждого растворителя определяется соответствующее значение крио-скопической и эбуллиоскопической постоянной, которое затем используется в расчетах. Е и К зависят только от природы
растворителя. 2-й закон Рауля
Повышение температуры кипения и понижение температуры затвердевания раствора над чистым растворителем прямо пропорционально моляльности раствора.
Таким образом, закипание раствора и кристаллизация раствора происходит в определенном интервале температуры.
Девиз: «ВОДА – ПРИЧИНА РАСПАДА
СОЕДИНЕНИЙ НА ИОНЫ.
ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ»
ЛЕКЦИЯ 9.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
План:
Сила электролитов.
Ионное произведение воды.
Ионные реакции.
Гидролиз солей.
Диссоциация электролитов в водном растворе.
При изучении основных закономерностей для растворов кислот, оснований и солей было показано, что они не подчиняются законам Вант-Гоффа и Рауля. Было установлено, что осмотическое давление, понижение температуры замерзания и повышение температуры кипения изменяется на одну и ту же величину
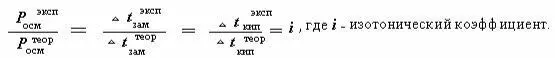
Для разбавленных растворов электролитов значение изото-нических коэффициентов определяется целочисленным значе-
нием i = 2, 3, 4.
В 1887г. для объяснения этих отклонений от законов Аррениусом была предложена теория, получившая впоследствии название теории электролитической диссоциации (э.д.).
Основные положения теории э.д.:
электролиты в водных растворах диссоциируют (распадаются) на ионы;
под действием электрического тока (+) заряженные ионы движутся к катоду, (-) заряженные (анионы) – к аноду;
диссоциация – обратимый процесс.
Впоследствии эта теория была развита в работах Каблукова и Кистяковского. На основании химической теории растворов Менделеева Каблуков впервые выдвинул гипотезу о гидратации ионов. Рассматривая механизм электролитической диссоциации следует остановиться на 2-х механизмах взаимодействия в растворе, I-ион дипольное взаимодействие, II-диполь-диполь-ное взаимодействие.
Рассмотрим процесс электролитической диссоциации на примере иондипольного взаимодействия
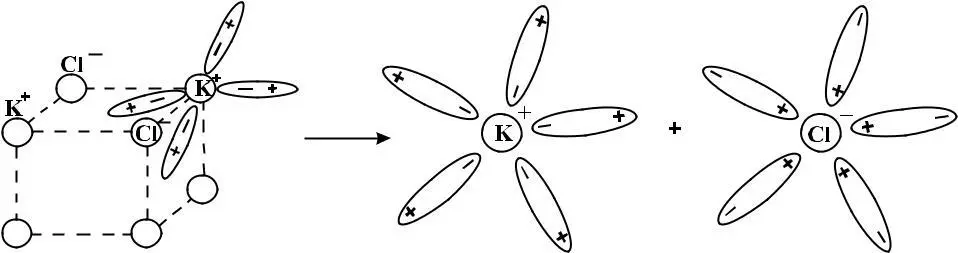
При помещении в водный раствор кристаллического ион-нопостроенного соединения полярные молекулы воды ориентируются противоположными концами относительно ионов кристалла. Происходит ослабление ионной связи с последующим разрывом. Следующий процесс заключается в образовании относительно (+) или (-) заряженных ионов, сольватных оболочек. При сольватации происходит образование слабых межмолекулярных химических связей.
Таким образом, сольватация или гидратация представляют собой основную причину электролитической диссоциации. Отсюда становится понятным физический смысл изотоничес-кого коэффициента: число ионов на которые распадается элек-тролит
HCl
H + + Cl -
i → 2
CaCl 2
Ca 2+ + 2Cl -
i → 3
Типы диссоциации. Сила электролита
Степенью э.д. называется отношение числа молекул, диссо-циирующих в растворе к общему числу молекул.
α = n/N, где n – число диссоциирующих молекул; N – общее число молекул в растворе
Условно считают, что если α > 30 % – то сильный электролит; α ÷ 2-30 % – электролит средней силы; α < 2 % – слабый электролит.
Существует зависимость между степенью э.д. и значением
изотонического коэффициента:
i = 1 + α (k – 1); где k – число ионов
Степень диссоциации зависит от:
природы и полярности растворителя (чем больше полярность тем выше степень диссоциации)
от природы и полярности вещества
от температуры (с повышением температуры степень диссоциации изменяется (уменьшается для сильных электролитов; для слабых – проходит через максимум)
от концентрации (с повышением концентрации степень диссоциации уменьшается)
Читать дальше
Конец ознакомительного отрывка
Купить книгу