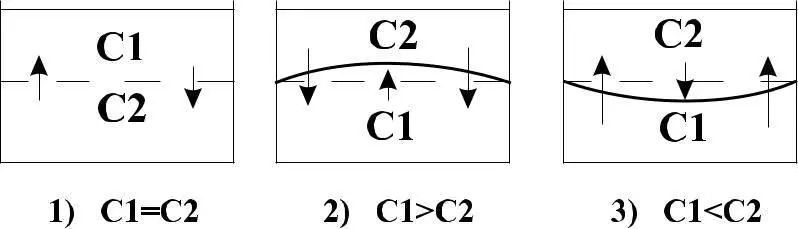
Во 2-м случае через полупроницаемую мембрану в раствор с большим значением концентрации будет переходить больше молекул растворителя. В этом случае произойдет увеличение объема, сопровождающееся повышением давления на мембрану. Мембрана прогнется вверх. 3-й случай является противоположным второму. Соответствующее давление, возникающее при этом, носит название осмотического давления. Для измерения О.Д. используют приборы, которые называются осмометрами.
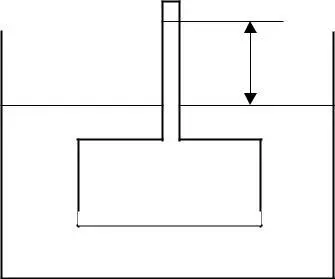



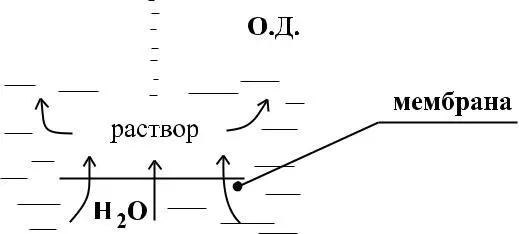
Давление, равное атмосферному, представляет собой осмо-тическое давление. О.Д. называется такое давление, которое необходимо приложить к раствору, чтобы прекратить осмос. Величина О.Д. зависит от концентрации раствора, от температуры, НО НЕ ЗАВИСИТ ОТ природы растворенного вещества и растворителя.
Растворы с одинаковым осмотическом давлением получили название изотонических растворов. Для определения осмотического давления разбавленных растворов используют эмпирические уравнения Вант-Гоффа. Так как в разбавленных растворах неэлектролитов межмолекулярное взаимодействие между молекулами растворимого вещества мало, то для такой системы можно использовать уравнение для идеальных газов Менделеева-Клапейрона:
pосмV = nRT → pосм = (n/V)RT = cRT
Используя метод измерения осмотического давления можно определить молекулярную массу растворимого вещества.
3.2 Давление насыщенного пара растворителя над раствором
Пар, находящийся в равновесии: со своим раствором, называется насыщенным. При определенном значении температуры давление насыщенного пара растворителя над раствором обозначим Р, чистого растворителя Р0

Таким образом, над раствором в соответствии с принципом Ле-Шателье происходит понижение концентрации молекул растворителя, т.е. давление насыщенного пара растворителя над раствором меньше давления насыщенного пара над чистым растворителем т.е. Р < Р0 Ро – Р – представляет собой понижение давления насыщенного пара растворителя над раствором, (Р0 – Р)/Р0 – относительное понижение давления насыщенного пара растворителя над раствором.
В результате многочисленных экспериментов удалось пока-
зать, что относительное понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворенного вещества (1 закон Рауля).
(Р – Р0 )/Р0 = N 2 = n2 /n 1 + n2, где N2 -мольная доля растворимого вещества, n1 – число молей растворителя, n2 – число молей
растворимого вещества.
1-й Закон Рауля используется для определения молекулярных масс растворимого вещества. Рассмотрим зависимость давления насыщенного пара растворителя над раствором от температуры.
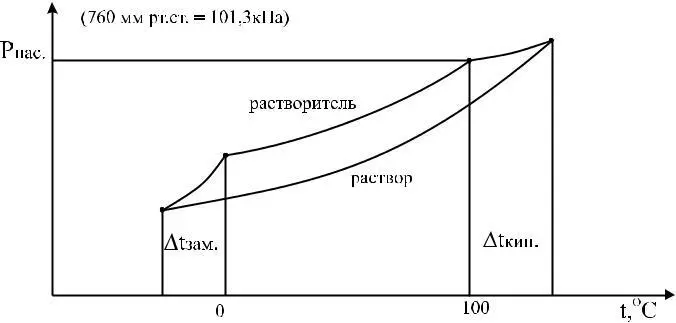
Жидкость закипает, когда давление насыщенного пара ста-новится равным атмосферному давлению. Жидкость затвердевает, когда давление насыщенного пара растворителя над раствором становится равным давлению насыщенного пара твердой фазы.
Следует отметить, что и температура затвердевания и температура кипения является индивидуальными характеристиками растворителя.
Кривая зависимости для раствора идет ниже кривой раство-
рителя, т.е. раствор закипает при более высотой температуре и затвердевает при более низкой температуре, чем чивстый раство-ритель.
Экспериментально было показано, что повышение температуры кипения и понижение температуры затвердевания пропорционально концентрации растворенного вещества, т.е.
Δtкип = E • mв, Δtзам = K • mв,
где Е – эбулиоскопическая постоянная; К – криоскопическая постоянная; mв – концентрация растворимого вещества (моляльность)
Читать дальше
Конец ознакомительного отрывка
Купить книгу



















