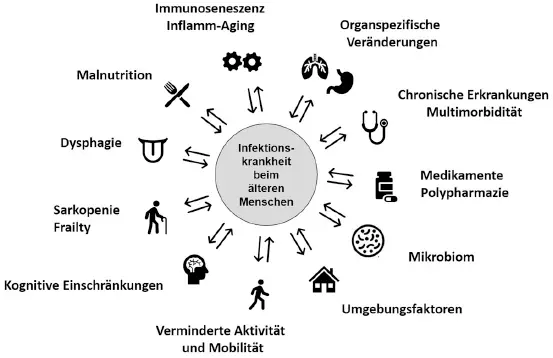
Abb. 1.1: Wichtige Faktoren, die die Inzidenz und den Verlauf von Infektionskrankheiten bei älteren Menschen beeinflussen und umgekehrt auch von Infektionskrankheiten beeinflusst werden.
1 Infektionsrelevante Besonderheiten älterer Menschen
1.1 Immunoseneszenz
Die Immunoseneszenz ist ein Alterungsprozess und kann zu den geriatrischen Syndromen gezählt werden. Sie bezeichnet die altersassoziierten Veränderungen des Immunsystems (Walford 1969). Die Immunoseneszenz beeinflusst die Infektionsanfälligkeit und den Verlauf von Infektionskrankheiten beim älteren Menschen sowie die Effizienz von Impfungen. Auch das bei älteren Menschen vermehrte Auftreten von Krebserkrankungen, Autoimmunerkrankungen und Erkrankungen, in deren Pathogenese Entzündungsprozesse eine Rolle spielen, ist zumindest teilweise bedingt durch die Immunoseneszenz (Gavazzi und Krause 2002).
Sowohl für Zellen des innaten Immunsystems (  Kap. 1.1.1) als auch des adaptiven Immunsystems (
Kap. 1.1.1) als auch des adaptiven Immunsystems (  Kap. 1.1.2) sind zahlreiche altersassoziierte Veränderungen beschrieben (Ventura et al. 2017). Altersassoziiert kommt es zur Entwicklung eines chronischen proinflammatorischen Status, dem sogenannten Inflamm-Aging (
Kap. 1.1.2) sind zahlreiche altersassoziierte Veränderungen beschrieben (Ventura et al. 2017). Altersassoziiert kommt es zur Entwicklung eines chronischen proinflammatorischen Status, dem sogenannten Inflamm-Aging (  Kap. 1.1.3; Franceschi et al. 2018). Weder das Ausmaß noch die Ursachen der Immunoseneszenz sind bisher vollends aufgeklärt (Crooke et al. 2019).
Kap. 1.1.3; Franceschi et al. 2018). Weder das Ausmaß noch die Ursachen der Immunoseneszenz sind bisher vollends aufgeklärt (Crooke et al. 2019).
1.1.1 Altersassoziierte Veränderungen des innaten Immunsystems
Das innate bzw. angeborene Immunsystem schützt den Körper vor dem Eindringen von Erregern und sorgt für deren schnelle Erkennung und Beseitigung. Zu denen klassischen Immunzellen des innaten Immunsystems gehören Granulozyten, Monozyten, Makrophagen, dentritische Zellen und natürliche Killerzellen. Auch humorale Bestandteile, das Komplementsystem und Zytokine sind an der innaten Immunantwort beteiligt.
Im Rahmen des Alterungsprozesses kommt es zu funktionellen Veränderungen aller Zelltypen des innaten Immunsystems. Hier sind insbesondere Beeinträchtigungen der Migration und Chemotaxis, der Phagozytosefähigkeit und Erregerelimination sowie der Antigenprozessierung und -präsentation zu nennen (Weiskopf et al. 2009; Pinti et al. 2016; 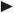 Tab. 1.1). Zudem verändert sich die Expression von Zytokinen und Toll-like-Rezeptoren (TLR).
Tab. 1.1). Zudem verändert sich die Expression von Zytokinen und Toll-like-Rezeptoren (TLR).
Tab. 1.1: Altersassoziierte Veränderungen von wichtigen Zellen und Bestandteilen des innaten Immunsystems
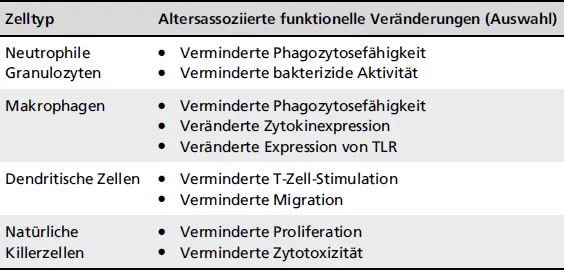
ZelltypAltersassoziierte funktionelle Veränderungen (Auswahl)
Makrophagen und Mikrogliazellen, die innaten Immunzellen des zentralen Nervensystems (ZNS), zeigen altersassoziiert eine veränderte Freisetzung proinflammatorischer Zytokine und eine reduzierte Phagozytosefähigkeit (Schütze et al. 2014; 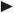 Abb. 1.2).
Abb. 1.2).
Im weiteren Sinne können die mechanischen und biochemischen Barrieren des menschlichen Körpers als erste Verteidigungslinie gegen Krankheitserreger zum innaten Immunsystem gezählt werden. Altersassoziierte Veränderungen dieser Barrieren werden als organspezifsche Alterungsprozesse in Kapitel 1.2 genauer beschrieben.
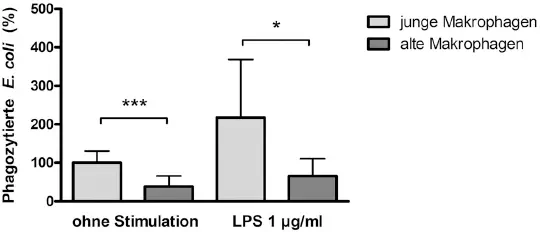
Abb. 1.2: Vergleich der Phagozytosefähigkeit von Makrophagen junger und alter Mäuse in ruhendem Zustand und nach Aktivierung durch LPS (Lipopolysaccharide) (adaptiert aus Schütze et al. 2014)
1.1.2 Altersassoziierte Veränderungen des adaptiven Immunsystems
Die Zellen des adaptiven Immunsystems, T- und B-Lymphozyten, können Antigene erkennen und gezielt zelluläre und humorale Abwehrmechanismen initiieren. Sie unterliegen zahlreichen altersassoziierten Veränderungen.
Das hämatopoetische Gewebe nimmt mit zunehmendem Lebensalter ab. Durch unreparierte DNA-Schäden, Telomerverkürzung, oxidativen Stress und veränderte Genexpression kommt es zu einer reduzierten Replikation, insbesondere der lymphoiden Zelllinie. Hieraus resultiert eine Verschiebung: mit zunehmendem Alter nimmt der Anteil der lymphoiden Zellen ab und der Anteil der myeoliden Zellen zu. Dies führt dazu, dass weniger B- und T-Vorläuferzellen gebildet werden und das Knochenmark verlassen (Pinti et al. 2016).
Der Thymus ist ein Organ des lymphatischen Systems, dessen Rückbildung, die Thymusinvolution, bereits mit dem Eintritt in die Geschlechtsreife beginnt und im Alter von etwa 50 Jahren abgeschlossen ist. Die Thymusgröße nimmt dabei ab, das funktionelle Gewebe (Cortex und Medulla) bildet sich zurück und wird durch Fettgewebe ersetzt. Dies führt dazu, dass weniger naive T-Zellen und regulatorische T-Zellen (Tregs) den Thymus verlassen (Tajima et al. 2016).
Altersassoziiert nimmt sowohl die Größe der Lymphknoten ab als auch ihre Schwellung als Reaktion auf Pathogene. Zunehmende Fibrosierung und andere strukturelle Veränderungen der Lymphknoten beeinflussen die Lymphozyten-Homeostase und ihre Migration im Rahmen der Immunantwort (Crooke et al. 2019).
Chronische persistierende Infektionen können dazu führen, dass die Kapazität des Immunsystems, auf neue Antigene zu reagieren, beeinträchtigt wird. Besonders gut untersucht ist dies für die Infektion mit dem Cytomegalie-Virus (CMV). Die CMV-Infektion ist eine lebenslang persistente meist latente Infektion, die 60–100% der Bevölkerung betrifft. Sie führt unter anderem zu Veränderungen des CD8+ T-Zell-Repertoirs: Es kommt zu einer Akkumulation von CMV-spezifischen CD8+ Effektor-T-Zellen, die bei älteren CMV-positiven Personen bis zu 25% des gesamten CD8+ T-Zell-Pools ausmachen können (Brunner et al. 2011).
Sowohl bei B- als auch bei T-Lymphozyten kommt es altersassoziiert zu einer veränderten Expression von Oberflächenantigenen. Für T-Lymphozyten ist eine veränderte Freisetzung von Zytokinen beschrieben (Pinti et al. 2016). Die Interaktion zwischen T- and B-Zellen ist eingeschränkt. Bei der Antikörperbildung durch B-Zellen kommt es altersassoziiert zu Störungen des Klassenwechsels (Isotypen-Switch) und zu einer Abnahme der Antikörperaffinität (Tabibian-Keissar et al. 2016). Im Serum älterer Personen sind vermehrt autoreaktive Antikörper, aber weniger fremdreaktive antigenspezifische IgG-Antikörper zu finden.
Tab. 1.2: Altersassoziierte Veränderungen von Zellen und Bestandteilen des adaptiven Immunsystems


ZelltypAltersassoziierte Veränderungen (Auswahl)
Читать дальше


 Kap. 1.1.1) als auch des adaptiven Immunsystems (
Kap. 1.1.1) als auch des adaptiven Immunsystems ( 














