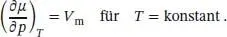Die kritischen Parameter von Wasser sind 374 °C und 218 atm – Bedingungen also, die technisch anspruchsvoller sind als im Fall von scCO 2. Auch hier hängen die Eigenschaften des Fluids empfindlich vom Druck ab: Bei abnehmender Dichte von scH 2O verhält sich das Medium nicht mehr wie eine wässrige Lösung, sondern wie eine nichtwässrige und schließlich wie eine gasförmige Lösung. Eine Folge ist, dass sich Reaktionsmechanismen verschieben, etwa von ionischen zu radikalischen Reaktionen.
1 1. Eine Phase ist eine Probe einer Substanz mit durchgehend homogener Zusammensetzung und gleichförmigem physikalischen Zustand.
2 2. Ein Phasenübergang ist die spontane Umwandlung einer Phase in eine andere.
3 3. Die thermodynamische Analyse von Phasen beruht auf dem Grundsatz, dass das chemische Potenzial einer Substanz in allen Phasen einer Probe gleich ist.
4 4. Das Phasendiagramm eines Stoffs ist eine grafische Darstellung der Druck‐ und Temperaturbereiche, in denen die einzelnen Phasen thermodynamisch stabil sind bzw. mit anderen Phasen im Gleichgewicht vorliegen.
5 5. Die Phasenregel stellt eine Verbindung zwischen der Zahl der Variablen her, die verändert werden können, ohne dass sich die Zahl oder die Art der Phasen im Gleichgewicht verändern.
Die wichtigsten Gleichungen auf einen Blick
| Stichwort |
Gleichung |
Anmerkung |
Nummer |
| Chemisches Potenzial |
μ = G m |
für eine reine Substanz |
|
| Phasenregel |
F = C − P + 2 |
F ist die Varianz, C ist die Anzahl der Komponenten und P ist die Anzahl der Phasen |
Gl. (4.1) |
4.2 Thermodynamische Betrachtung von Phasenübergängen
Motivation
Mithilfe thermodynamischer Argumente lässt sich das Aussehen von Phasendiagrammen erklären, und wir können die Auswirkungen einer Druckänderung auf Phasenübergänge vorhersagen. Auf diese Weise gewinnen wir wichtige Erkenntnisse über die Eigenschaften, die das Verhalten von Materie unter verschiedenen Bedingungen bestimmen.
Das chemische Potenzial einer Substanz nimmt bei steigender Temperatur proportional zu ihrer molaren Entropie ab, und es nimmt bei steigendem Druck proportional zu ihrem Molvolumen zu.
Die thermodynamische Bedingung für ein Phasengleichgewicht ist, dass das chemische Potenzial einer Substanz in jeder Phase gleich sein muss ( Abschn. 4.1). Außerdem sollte Ihnen bekannt sein, dass das Ausmaß der Variation der molaren Freien Enthalpie einer Substanz von ihrem Molvolumen und der molaren Entropie abhängt ( Abschn. 3.5). In diesem Abschnitt greifen wir auf Ausdrücke für die Entropie von Phasenübergängen ( Abschn. 3.2) und die Zustandsgleichung des idealen Gases ( Abschn. 1.1) zurück.
Wie wir gesehen haben, ist die thermodynamische Bedingung für ein Phasengleichgewicht, dass das chemische Potenzial einer Substanz in jeder Phase gleich sein muss. Für ein Einkomponentensystem ist das chemische Potenzial identisch mit der molaren Freien Enthalpie der Phase ( μ = G m). Aus Abschn. 3.5wissen wir bereits, wie die Freie Enthalpie von Druck und Temperatur abhängt:

Diese Ausdrücke gelten in analoger Form auch für die molare Freie Enthalpie, und somit für das chemische Potenzial. Wir verwenden die Schreibweise für partielle Ableitungen, wie sie in „Toolkit 9: Partielle Ableitungen“ in Abschn. 2.1vorgestellt wurde, und erhalten:
(4.3a) 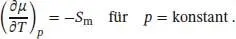
Diese Beziehung drückt aus, dass das chemische Potenzial eines reinen Stoffs mit steigender Temperatur sinkt (da immer S m> 0 gilt, ist die Steigung der Funktion μ ( T ) stets negativ).
(4.3b) 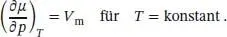
Diese Beziehung drückt aus, dass das chemische Potenzial eines reinen Stoffs mit steigendem Druck zunimmt (da immer V m> 0 gilt, ist die Steigung der Funktion μ ( p ) stets positiv).
Durch Kombination dieser beiden Beziehungen für die Variation von μ mit der Temperatur bzw. dem Druck mit der Tatsache, dass die chemischen Potenziale einer reinen Substanz in jeder Phase identisch sind, sollten wir in der Lage sein abzuleiten, wie sich Phasengleichgewichte bei einer Änderung der Bedingungen verhalten.
4.2.1 Abhängigkeit der Stabilität von den Bedingungen
Bei tiefen Temperaturen und nicht zu geringem Druck hat die feste Phase eines Stoffs das niedrigste chemische Potenzial und ist deshalb die stabile Phase. Da jedoch die chemischen Potenziale der einzelnen Phasen in unterschiedlicher Weise von der Temperatur abhängen (da die molare Entropie jeder Phase unterschiedlich ist), kann bei Temperaturerhöhung das chemische Potenzial einer anderen Phase (einer anderen festen, einer flüssigen oder auch einer gasförmigen) niedriger werden. In diesem Fall findet ein Phasenübergang statt, sofern keine kinetische Hemmung vorliegt.
(a) Die Temperaturabhängigkeit der Stabilität von Phasen
Da für alle Substanzen oberhalb von T = 0 immer S m> 0 ist, gilt gemäß Gl. (4.3a), dass das chemische Potenzial eines reinen Stoffs mit steigender Temperatur sinkt. Außerdem ist ersichtlich, dass die Steigung der Funktion μ ( T ) für Gase größer ist als für flüssige Phasen – wegen S m(g) > S m(l) – und dass diese Funktion fast immer für Flüssigkeiten steiler absinkt als für Festkörper, da bis auf wenige Ausnahmen S m(l) > S m(s) gilt (siehe dazu Abb. 4.13). Die Kurve fällt für μ (l) so steil ab, dass sie bei hinreichend hoher Temperatur schließlich unterhalb von μ (s) verläuft: die Flüssigkeit wird zur stabilen Phase, der Festkörper schmilzt freiwillig. Das chemische Potenzial der Gasphase fällt (aufgrund ihrer hohen molaren Entropie) mit steigender Temperatur stark ab; von einer bestimmten Temperatur an ist dann der gasförmige Aggregatzustand stabil und die Flüssigkeit verdampft freiwillig.
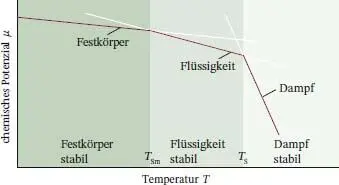
Abb. 4.13 Schematische Darstellung der Temperaturabhängigkeit des chemischen Potenzials der festen, flüssigen und gasförmigen Phase eines Stoffs (in Wirklichkeit sind die Linien gekrümmt). Die Phase mit dem jeweils niedrigsten chemischen Potenzial ist bei einer gegebenen Temperatur die stabilste. Bei den Übergangstemperaturen ( T Smund T S) sind die chemischen Potenziale der beiden betreffenden Phasen gleich groß.
Die molare Standardentropie von flüssigem Wasser bei 100 °C ist 86,8 J K −1mol −1und diejenige von Wasserdampf bei derselben Temperatur ist 195,98 J K −1mol −1. Wenn die Temperatur um 1,0 K erhöht wird, ändern sich die chemischen Potenziale wie folgt:
Читать дальше