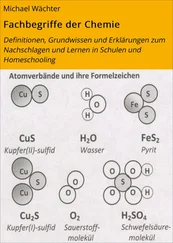
Betrachten Sie den in Abb. 4.9eingezeichneten Pfad zwischen den Punkten ABCD. Am Punkt A liegt Wasser als Eis‐V vor. Bei zunehmendem Druck bis zum Punkt B bei derselben Temperatur bildet sich Eis‐VIII. Ein Anstieg der Temperatur bis zum Punkt C führt zur Bildung von Eis‐VII, und eine Reduktion des Drucks bis zum Punkt D führt zum Schmelzen des Feststoffs zu flüssigem Wasser.
Bei der Diskussion von Helium bei tiefen Temperaturen muss man zwischen den Isotopen 3He und 4He unterscheiden. Bei 3He handelt es sich um ein Fermion, und 4He ist ein Boson – daher verhalten sich diese Isotope gemäß dem Pauli‐Prinzip aus quantenmechanischen Gründen unterschiedlich (siehe Abschn. 8.2). Das Phasendiagramm von 4He ist in Abb. 4.11dargestellt. Helium zeigt bei tiefen Temperaturen ein ungewöhnliches Verhalten, da seine Atome eine so kleine Masse besitzen und die geringe Zahl seiner Elektronen zu außergewöhnlich schwachen Wechselwirkungen zwischen ihnen führt. Bei einem Druck von 1 atm existiert nirgends (auch nicht bei sehr niedrigen Temperaturen), ein Gleichgewicht zwischen fester und Gasphase: Die Heliumatome schwingen durch ihre geringe Masse mit so großer Amplitude, dass ein Festkörper nicht stabil wäre. Festes Helium kann man nur herstellen, indem man bei niedrigen Temperaturen einen Druck anlegt, der die Atome „mit Gewalt“ zusammenhält.
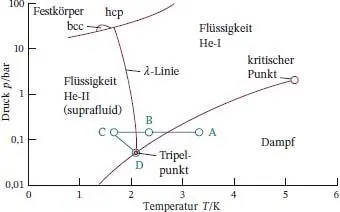
Abb. 4.11 Phasendiagramm von Helium ( 4He). Die λ ‐Linie kennzeichnet die Bedingungen, bei denen beide flüssigen Phasen im Gleichgewicht vorliegen. Helium‐II ist die suprafluide Phase. Festes Helium kann man erst bei Drücken oberhalb von 20 bar gewinnen. Die Bezeichnungen hcp (von engl. hexagonally close‐packed ; hexagonal dichte Packung) und bcc (von engl. body‐centered cubic ; kubisch raumzentriert) stehen für feste Phasen mit unterschiedlicher Kristallstruktur (diese Strukturen werden in Abschn. 15.1beschrieben). Der Pfad zwischen den Punkten ABCD wird in Illustration 4.8diskutiert.
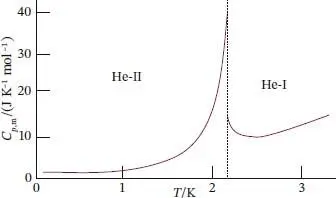
Abb. 4.12 Die Wärmekapazität von suprafluidem Helium‐II steigt mit der Temperatur umso stärker an, je näher man sich der Übergangstemperatur zu Helium‐I annähert. Aufgrund des Verlaufs des Graphen in dieser Auftragung hat sich die Bezeichnung λ ‐Übergang durchgesetzt; die Phasengrenze zwischen den beiden flüssigen Phasen im Phasendiagramm nennt man λ ‐Linie.
Reines 4He besitzt zwei flüssige Phasen. Eine von ihnen (im Diagramm mit He‐I) bezeichnet) verhält sich wie eine gewöhnliche Flüssigkeit, die andere (He‐II) ist ein Suprafluid(ihre Viskosität ist null). Neuere Forschungsarbeiten deuten darauf hin, dass auch Wasser eine suprafluide Phase haben könnte. Abgesehen von den in Anwendung 8: „Materialwissenschaft – Flüssigkristalle“ am Ende von Abschn. 5.3vorgestellten Flüssigkristallen ist Helium der einzige Stoff mit einem Phasenübergang zwischen zwei flüssigen Phasen; in Abb. 4.11ist die zugehörige Phasengrenze, die λ‐Linie(Lambda‐Linie), gekennzeichnet. Sie wird so bezeichnet, da eine Auftragung der Wärmekapazität von 4He gegen die Temperatur bei der Übergangstemperatur an die Gestalt des griechischen Buchstabens Lambda erinnert ( Abb. 4.12).
Das Phasendiagramm von 3He ist anders aufgebaut, aber auch von diesem Isotop kennt man eine suprafluide Phase. Eine weitere ungewöhnliche Eigenschaft ist, dass am Schmelzpunkt die Entropie der Flüssigkeit größer ist als die des Festkörpers und der Schmelzvorgang daher exotherm verläuft (Δ Sm H < 0 wegen Δ Sm S = Δ Sm H / T Sm).
Betrachten Sie den in Abb. 4.11eingezeichneten Pfad zwischen den Punkten ABCD. Am Punkt A liegt Helium als Gas vor. Eine Abkühlung des Gases bis zum Punkt B führt zur Kondensation zu flüssigem Helium‐I, und bei noch geringeren Temperaturen bis zum Punkt C zur Bildung von flüssigem Helium‐II. Wenn sich der Druck und die Temperatur von Punkt D einstellen, liegen in dem System drei Phasen (Helium‐I, Helium‐II, und gasförmiges Helium) im Gleichgewicht vor.
Anwendung 6:4.1 Technologie – Überkritische Fluide
Überkritisches Kohlendioxid, abgekürzt scCO 2(von engl. supercritical ), kommt bei immer mehr Prozessen als Lösungsmittel zur Anwendung. Sein kritischer Druck (72,9 atm) und seine kritische Temperatur (304,2 K oder 31,0 °C) sind technisch gut erreichbar, die Substanz ist billig und lässt sich problemlos wiederverwerten. Die Dichte von CO 2am kritischen Punkt beträgt 0,45 g cm −3. Die Transporteigenschaften (Diffusionsverhalten, Viskosität, Wärmeleitfähigkeit) überkritischer Fluide hängen entscheidend von ihrer Dichte ab, die ihrerseits empfindlich auf Druck‐ und Temperaturänderungen reagiert. Auf diese Weise lässt sich die Dichte von scCO 2zwischen 0,1 g cm −3(gasähnlich) und 1,2 g cm −3(flüssigkeitsähnlich) einstellen. Als Faustregel gilt, dass die Löslichkeit eines zu lösenden Stoffs exponentiell von der Dichte des überkritischen Lösungsmittels abhängt. Kleine Druckänderungen, insbesondere in der Umgebung des kritischen Punkts, können die Löslichkeit deshalb stark beeinflussen. Da auch die relative Permittivität (Dielektrizitätskonstante) eines überkritischen Fluids empfindlich von Druck und Temperatur abhängt, kann man Reaktionen unter polaren und unpolaren Bedingungen durchführen, ohne dabei das Lösungsmittel wechseln zu müssen; auf diese Weise lassen sich Lösungsmitteleinflüsse untersuchen.
Zu den wichtigen Vorteilen von überkritischem scCO 2zählt, dass es sich nach Gebrauch aus dem System entfernen lässt, ohne schädliche Rückstände zurückzulassen. Diese Tatsache (gemeinsam mit der niedrigen kritischen Temperatur) empfiehlt das Lösungsmittel besonders für die Nahrungsmittelindus trie (zum Beispiel zum Entkoffeinieren von Kaffee oder Entfetten von Milch) und die Arzneimittelherstellung. Zunehmend verwendet man scCO 2auch in der chemischen Reinigung als Ersatz für krebserregende, umweltschädliche chlorierte Kohlenwasserstoffe.
Seit den 1960er Jahren wird scCO 2als mobile Phase in der Flüssigkeitschromatografie mit überkritischen Fluiden (engl. supercritical fluid chromatography , SFC) eingesetzt. Dieses Verfahren wurde zwischenzeitlich weitgehend von der bequemeren Hochleistungs‐Flüssigkeitschromatografie (engl. high performance liquid chromatography , HPLC) verdrängt, findet aber neuerdings wieder Interesse, weil sich damit auch Trennungsaufgaben lösen lassen, die der HPLC Schwierigkeiten bereiten (beispielsweise die Trennung von Lipiden und Phospholipiden). Auf diese Weise lassen sich Probenmengen bis in den Piktogramm‐Bereich analysieren. Der entscheidende Vorteil der SFC besteht darin, dass die Diffusionskoeffizienten in überkritischen Fluiden um eine Größenordnung über denjenigen in gewöhnlichen Flüssigkeiten liegen; der Diffusion des gelösten Stoffs durch die chromatografische Säule wird deswegen weniger Widerstand entgegen gesetzt, die Stofftrennung wird beschleunigt oder die Auflösung des Verfahrens steigt.
Leider ist überkritisches CO 2kein besonders gutes Lösungsmittel. Viele potenziell interessante Substanzen lassen sich nur mithilfe oberflächenaktiver Hilfsmittel in Lösung bringen. Die Wirtschaftlichkeit von Reinigungsverfahren auf scCO 2‐Basis hängt daher von der Verfügbarkeit preiswerter Tenside ab; ähnliches gilt für den Einsatz von scCO 2als Lösungsmittel für homogene Katalysatoren (wie Metallkomplexe). Bislang gibt es zwei Ansätze, um diesem Problem zu begegnen: Die Anwendung fluorierter und siloxanbasierter polymerer Stabilisatoren ermöglicht den Ablauf von Polymerisationen in scCO 2. Da diese Hilfsstoffe für den kommerziellen Einsatz zu teuer sind, greift man neuerdings auf die wesentlich billigeren Poly(ether‐carbonat)‐Copolymere zurück, deren Löslichkeit in scCO 2durch Veränderung des Verhältnisses zwischen Ether‐ und Carbonatgruppen beeinflusst werden kann.
Читать дальше