Oxidationsmittel sind charakterisiert durch die allgemeine Fähigkeit, Elektronen aufzunehmen. Als solche stehen sie den Reduktionsmitteln komplementär gegenüber, die leicht Elektronen abgeben. Alle Reduktionsmittel haben in der oxidierenden Erdatmosphäre (mit einem Sauerstoffgehalt von 20%) die Tendenz zur Autoxidation. Starke Reduktionsmittel sind technisch unverzichtbar, aber wegen der Erzeugung von Sauerstoffradikalen bei andauernder geringer Exposition ziemlich toxisch. Zu ihnen zählen anorganische Verbindungen wie Dithionit-Natrium (NaO 2S−SO 2Na), Hydrazin (H 2N‒NH 2) und Hydroxylamin (HO‒NH 2).
Das Hydroxylamin entsteht in vivo aus den medizinisch verwendeten Sulfonamiden, die darum als Pro-oxidantien zu gelten haben. Sie werden immer wieder, von profitgetriebenen Autoritäten, wirklichen oder angeblichen Risikopatienten unbefristet zur Prävention von Infektionskrankheiten aufgedrängt.
Auch der ubiquitäre Metabolit Glukose ist ein Reduktionsmittel. Glukoselösungen reduzieren beispielsweise Silbersalze zu metallischem Silber, und in geringem Umfang reduzieren Glukoselösungen auch den Luftsauerstoff, wobei Wasserstoffperoxid entsteht (Abb. III-2). Die Autoxidation der Glukose findet auch im lebenden Organismus statt, wo nach Maßgabe des Blutzuckerspiegels toxisches Wasserstoffperoxid entsteht. Der Blutzuckerspiegel – genau genommen ist immer der Blutglukosespiegel gemeint, wird bei Gesunden durch hohen Zuckerkonsum vorübergehend erhöht – immerhin! beim unbehandelten Diabetes ist er permanent erhöht.
Eine wichtige Gruppe der Pro-oxidantien sind die RedOx-Zykler. In reduzierter Form autoxidieren sie spontan mit Sauerstoff ‒ unter Bildung des toxischen Superoxid-Radikals, um dann sogleich aufs Neue reduziert zu werden. Die Reduktion der Redoxzykler erfolgt entweder spontan durch eine Reaktion mit natürlichen Metaboliten, oder durch eine enzymatisch katalysierte Wasserstoffübertragung. Die Toxizität xenobiotischer Redoxzykler beruht mithin auf der Erzeugung von Superoxid und auf dem Entzug von reduktiven Valenzen, so dass die Zelle reguläre reduktive Funktionen nicht mehr befriedigend erfüllen kann (Liochev et al. 1994).
Berüchtigte Redoxzykler sind der Vitamin-K-Ersatzstoff Menadion (Abb. IV-10), und das Herbizid Paraquat. Das Menadion wird in tierischen Zellen durch den Metaboliten Glutathion aktiviert, indem dessen Sulfhydrylgruppe (R−SH) spontan Wasserstoff ans Menadion abgibt. Die 2[H] aus der Gleichung
2R−SH →R−S-S−R + 2[H]
reduzieren das Menadion, das dann sofort autoxidiert ‒ unter Bildung von zwei toxischen Superoxid-Radikalen. Glutathion, chemisch ein Tripeptid aus den Aminosäuren Glycin, Glutamat und Cystein ( siehe Abb. V-2), hat die wichtige Funktion, das RedOx-Gleichgewicht in den Zellen und im Blut zu stabilisieren. In diesem Zusammenhang dient es dem wichtigen anti-oxidativen Enzym Glutathion-peroxidase als Lieferant von reduzierenden Äquivalenten, d.h. von aktivem Wasserstoff. Das Enzym Glutathionperoxidase reduziert mit Hilfe von Glutathion zum Beispiel toxische Fettsäure-hydroperoxide zu wertvollen Fettsäure-alkoholen (Hydroxyfettsäuren, Abb. IV-8).
Die reduktive Kraft des Glutathions reicht zur spontanen reduktiven Aktivierung des Herbizids Paraquat nicht aus, und es gibt auch keine anderen gewöhnlichen Metaboliten des menschlichen Organisms mit hinreichend reduktiver Kraft. Um Paraquat zu reduzieren, bedarf es eines katalytischen Enzyms – einer Reduktase (Liochev et al. 1994). Grüne Pflanzen enthalten Paraquat-reduzierende Reduktasen. Die gehören zum photosynthetischen Apparat, weshalb von interessierter Seite die Meinung gefördert wird, dass Paraquat ein für Tier und Mensch ungefährliches Herbizid sei. Doch bereits das gewöhnliche Darmbakterium Escherichia coli verfügt über eine Reduktase, die zufällig das Paraquat effizient reduziert, welches dann ohne Verzug – unter Bildung von Superoxid – autoxidiert, um sogleich erneut reduziert zu werden. Deshalb ist E. coli sehr empfindlich gegen Paraquat. Andere Mikroben, die über keine geeignete Reduktase verfügen, sind völlig unempfindlich. Auch die Zellen des menschlichen Organisms sind gegen Paraquat unempfindlich, so dass es um so beherzter als Herbizid eingesetzt wird. Aber spezialisierte Nervenzellen von idiosynkratisch sensiblen Individuen scheinen doch empfindlich zu sein, weil Paraquat aufgrund epidemiologischer Daten ätiologisch mit dem neurodegenerativen Parkinsonismus verwickelt scheint. Das Misstrauen nährt sich auch aus der strukturellen Verwandtschaft des Paraquat mit dem MPTP (Abb. III-5). MPTP ist eine Chemikalie, die bei Primaten und Menschen binnen kurzer Zeit fatalen Parkinsonismus induziert (Langston et al. 1983). Möglicherweise wird MPTP endogen gebildet – aus der Aminosäure Tryptophan und dem Alkoholmetaboliten Acetaldehyd sowie dem Zuckermetaboliten Pyruvat (Abb. III-5).
Auch natürliche essenzielle Redoxzykler der Atmungskette sind Pro-oxidantien − und darum potenziell gefährlich. Das ist verständlich, weil die Essenz der Zellatmung darin besteht, Energie für schwere Zellarbeit unmittelbar verfügbar zu machen, indem der in den Nahrungsmitteln gebundene energiereiche Wasserstoff [H] mit dem eingeatmeten Sauerstoff (O 2) nass verbrannt wird, wobei viel Energie frei wird – wie bei der formal identischen Knallgasreaktion. Dazu müssen pro O 2-Molekül vier Wasserstoffatome (Elektronen) übertragen werden. Damit das ohne Freisetzung von intermediären Sauerstoffradikalen (Abb. II-3) geht, muss die Übertragung der vier Elektronen gleichzeitig erfolgen. Diese kritische Aufgabe erfüllt ein besonderes RedOx-Enzym – die Cytochromoxidase. Das aktivierte Enzym enthält als Elektronenüberträger je zwei reduzierte Eisen-Ionen (Fe 2+) und zwei reduzierte Kupfer-Ionen (Cu +). Durch die Reaktion mit O 2entstehen Fe 3+- und Cu 2+-Ionen, die dann erneut reduziert werden.
Ein auf die Zellatmung spezialisierter essenzieller Redoxzykler ist das Ubichinon (Abb. IV-9). Seine ein- und zweifach reduzierten Formen Ubisemichinon und Ubichinol finden sich in der Zelle lokalisiert zwischen den beiden Schwanz-an-Schwanz angeordneten Schichten der Membranen (Abb. II-2), und dort sind sie vor spontaner Autoxidation sicher – so lange wie die Membran strukturell unversehrt bleibt.
Eine unregulierte Autoxidation von Ubisemichinon und Ubichinol, die zur massenhaften Erzeugung von unvollständig reduziertem Sauerstoff führt ‒ zu den Sauerstoffradikalen (Abb. II-3), beginnt jedoch, sobald die Struktur der atmungsaktiven Membran verzerrt wird. Membranverzerrungen entstehen durch Einwirkung kleinmolekularer lipophiler Stoffe, die daher ebenfalls als Pro-oxidantien gelten. Sie sind chemisch divers und weitverbreitet (Tab. II-1). Sie benötigen für ihre membranverzerrende Wirkung mit pro-oxidativen Konsequenzen, entgegen weitverbreiteter Meinung, keine metabolische Aktivierung.
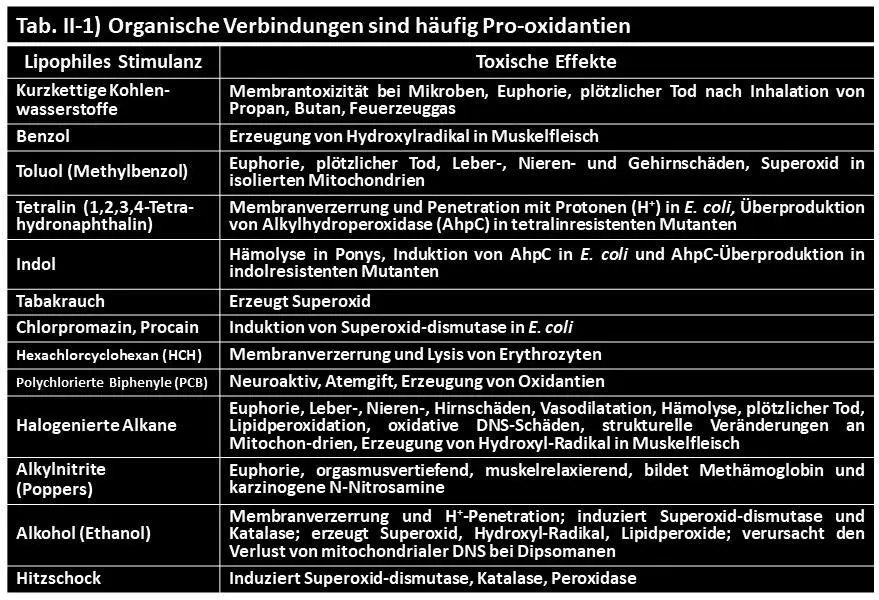
Die Membranverzerrungen durch Exposition mit lipophilen Stoffen (Tab. II-1) kommen durch unspezifische Einwirkung an verschiedenen Stellen der quasi supermolekularen Membran zustande. Ein Angriffspunkt liegt an der Oberfläche der Membran (Abb. II-2a), die aus den aneinandergereihten polaren Köpfen der ansonsten unpolaren Membranlipide besteht (Abb. II-2b, c). Dadurch wird die Membran äußerlich hydrophil und tritt mit den umgebenden Wassermolekülen in elektrische Wechselwirkung – unter spontaner Ausbildung von Wasserstoffbrücken (Abb. V-1b). Deren Bildung wird durch gelöste Stoffe im Wasser gestört. Besonders störend wirkt der lipophile Alkohol − der noch hydrophil genug ist, dass er sich unbegrenzt mit Wasser mischt. Auch die Membranen der Nervenzellen, die für die Reizleitung funktionell unabdingbar sind, werden durch Alkohol kompromittiert, und das wird als Berauschung subjektiv wahrgenommen.
Читать дальше













