В начале XX века вопрос о природе атома – мельчайшей частицы вещества, являющейся носителем его свойств, – был одним из центральных в физике. Предлагаемые модели, будучи внутренне противоречивыми или не соответствующими эксперименту, одна за другой опровергались. И вот в 1913 году датский физик Нильс Бор (илл. 2, справа) предложил математически простую теорию атома, объясняющую существующие экспериментальные данные, однако основанную на столь необычных допущениях, что он сам назвал их постулатами.
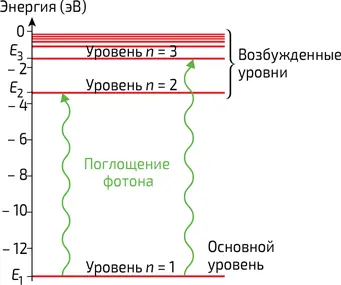
4. Энергетическая диаграмма атома водорода. Атом переходит из основного состояния в возбужденное путем поглощения фотона, энергия которого Δ E = hυ соответствует разнице между двумя энергетическими уровнями атома. Энергия выражается в электронвольтах (1 эВ = 1,6•10 –19Дж)
Нильс Бор, предлагая свою модель атома, ничего не знал о принципе неопределенности, до открытия которого оставалось еще 14 лет. В модели Бора, как и в модели Резерфорда, электрон вращается вокруг ядра, подобно тому как Земля вращается вокруг Солнца, однако при этом электрон может двигаться только по определенным орбитам (илл. 5). Например, круговые орбиты возможны только в том случае, когда произведение импульса mv электрона на радиус его орбиты R (это произведение называют «моментом импульса») является кратным постоянной Планка:
mvR = nħ. (4)
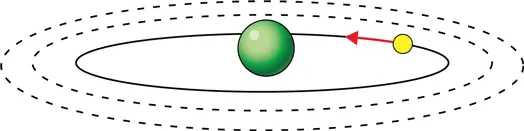
5. Атом водорода в представлении Резерфорда и Бора в начале XX века
Однако импульс электрона и радиус орбиты связаны также и тем обстоятельством, что действующая на электрон центробежная сила (см. главу 4, «Еще одна фиктивная сила: центробежная»), равная mv 2/ R , должна компенсировать силу электростатического притяжения. Для атома водорода, ядро которого состоит из протона, последняя равна – e 2/(4πε o R ). Отсюда уже можно найти радиусы R n–1 разрешенных орбит для каждого значения n . Так, для n = 1 находим уже знакомое нам значение R 0 , которое соответствует основному состоянию. Предоставим читателю самому вывести общую формулу, применимую к возбужденным состояниям электрона.
Модель Бора, разработанная в 1913 году, довольно хорошо описывала спектры излучения атомов (илл. 6), однако вскоре выявились и ее недостатки. Спустя десять лет теория Бора была концептуально расширена введением вероятностного описания нахождения электрона. Так оказалось, что значение R 0 (расстояние от электрона до ядра) в атоме водорода может считаться лишь некоей усредненной величиной; принцип неопределенности не позволяет четко определить расстояние между протоном и электроном.
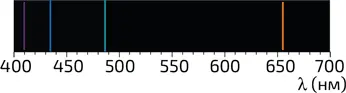
6. Модель Бора позволяет объяснить спектр излучения атома водорода в видимой области. Линии, расположенные вблизи длин волн излучения в 410, 434, 486 и 656 нм, соответствуют переходам на уровень, соответствующий n = 2 из возбужденных состояний n = 6, 5, 4 и 3 (см. илл. 4)
Предположим, что в какой-то момент нам удалось установить положение электрона. Можно ли предсказать его положение через секунду? Нет, поскольку знание положения электрона неизбежно привело бы к полной неопределенности его скорости. Ни один прибор, ни одна теория не смогли бы предсказать, куда направится электрон. Так что же делать?
Сменим стратегию и отметим точку пространства, в которой обнаружен электрон, затем еще одну точку – результат аналогичного измерения с другим электроном, и многократно повторим эту процедуру. Хоть и невозможно предсказать, где появится следующая отметка, все же их распределение следует некоему правилу. Плотность отметок, которая варьирует в зависимости от точки пространства, указывает на вероятность нахождения электрона во время измерения. Мы были вынуждены отказаться от описания движения электрона, но можем теперь определить вероятность его нахождения в каждой точке пространства. Поведение электрона в наномире характеризуется вероятностью!
Читатель, не знакомый с этой концепцией, не может оценить роль случайности в законах природы. Эйнштейн, являясь одним из основателей квантовой физики (илл. 7), был потрясен предложенной концепцией квантового индетерминизма. Убежденный детерминист, он однажды написал Максу Борну: «Бог не играет в кости» [28] Бор ответил: «Не наше дело предписывать Богу, как ему следует управлять этим миром!»
. Тем не менее, как вы увидите, такая вероятностная теория подтверждается серьезными экспериментальными доказательствами.
Читать дальше
Конец ознакомительного отрывка
Купить книгу







![Лина Сайфер - Театр мыльных пузырей [litres]](/books/434478/lina-sajfer-teatr-mylnyh-puzyrej-litres-thumb.webp)






