La cerrada interacción entre el ganado doméstico y la vida silvestre aumenta la probabilidad de transmisión de la enfermedad entre el ganado, la fauna y los seres humanos. Los brotes de enfermedades como la fiebre aftosa han causado graves trastornos a la persistencia de las especies silvestres, como el caso de la gacela de Mongolia (Procapra gutturosa). Todos los organismos nacionales de Mongolia comenzaron a culpar a las gacelas como la fuente de la transmisión de fiebre aftosa, lo cual llevó a decretar el sacrificio de todas ellas (Shiilegdamba et al., 2011; Berrian et al., 2016).
Condiciones ambientales en la interfaz que favorecen el mantenimiento y la dispersión del patógeno
Otro aspecto para plantear es que las temperaturas controlan la distribución diaria de los periodos de actividad de los búfalos. Estos pastan principalmente en la noche, tiempo en el que disminuye el periodo de calentamiento; en el día lo hacen durante los periodos fríos. Las condiciones climáticas pueden influir en el número de búfalos que escapan. Los contactos entre búfalos y el ganado también dependen de la sincronía entre sus actividades diarias y de su ubicación en cuanto a la disposición de alimentos (Dion y Lambin, 2012; Wieland et al., 2015).
Respecto al consumo de agua, los búfalos beben como mínimo una vez al día y se mueven hacia el punto de agua más cercano. Hay que mencionar, además, que el río Sabie bordea la valla del parque y es muy atractivo para beber; por lo tanto, favorece la presencia de los animales cerca de los límites del parque. Se infiere que si se añadieran puntos de agua en el interior del parque, los búfalos podrían mantenerse dentro de las instalaciones y así limitar su presencia contigua a la cerca; esto podría reducir el número de los búfalos que se escapan del parque (Dion y Lambin, 2012).
Sin embargo, otro de los aspectos es el crecimiento demográfico en los asentamientos humanos adyacentes al parque. Esto reduce las áreas de pastoreo disponibles y aumenta el número de bovinos que pueden estar en contacto con búfalos. Es probable que este crecimiento de asentamientos reduzca las zonas comunes reservadas para el pastoreo y desplace el ganado más cerca de la frontera con el parque, lo cual puede aumentar la probabilidad de contacto entre las dos especies. Si se considera el papel importante del ganado en los medios de subsistencia de los hogares rurales, el incremento de la población humana también podría estar asociado con un aumento de población de ganado (Jori y Etter, 2016).
Por otro lado, la quema controlada se utiliza ampliamente en las sabanas como manejo de la tierra, herramienta para aumentar la diversidad del paisaje. Por consiguiente, la quema controlada a lo largo de la frontera del parque hace que los búfalos escapen, ya que salen a buscar los corredores con vegetación de calidad. En consecuencia, una banda de vegetación quemada a lo largo de la valla podría romper la conexión entre la vegetación dentro y fuera del parque y así reducir el número de búfalos que escapan (Jori y Etter, 2016). Los factores que influyen en la dispersión de la fiebre aftosa se presentan en la figura 1.
FIGURA 1
DIAGRAMA DE LA TRÍADA ECOEPIDEMIOLÓGICA DE HOSPEDEROS Y RESERVORIOS DE LA ENFERMEDAD
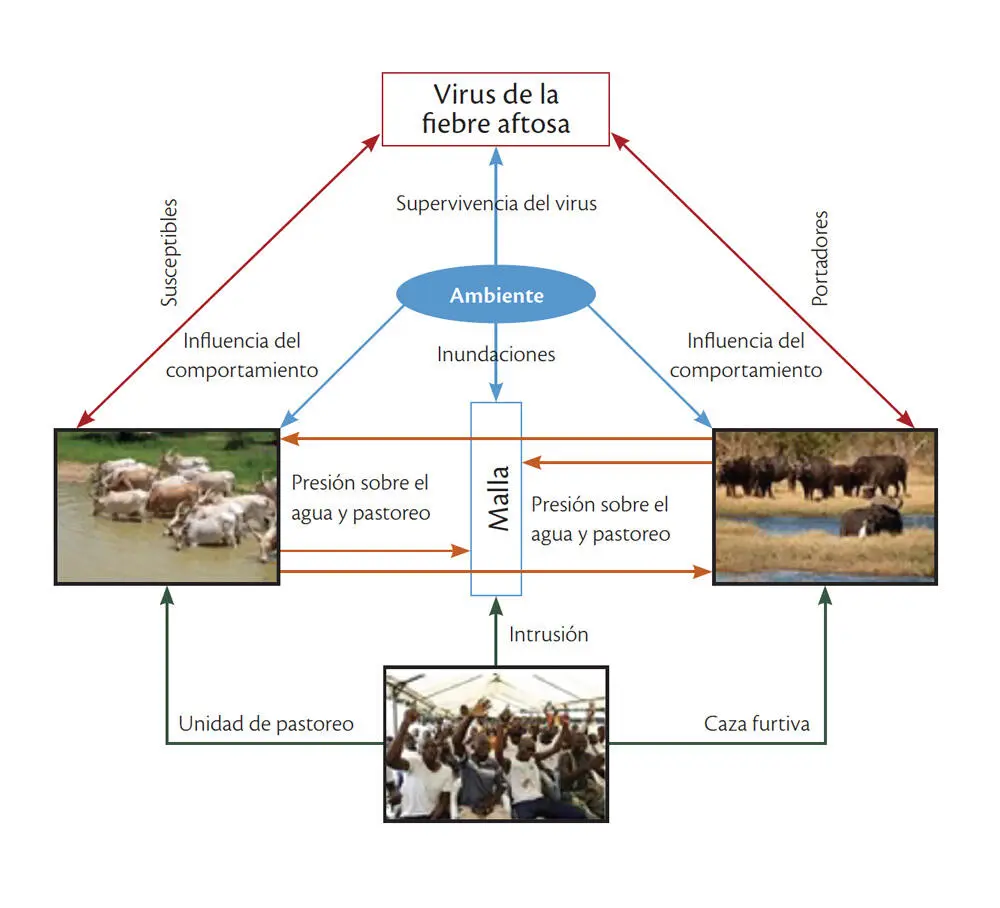
Fuente: elaboración propia.
Estrategias de prevención y control de la fiebre aftosa
A continuación se presentan algunas formas para prevenir y controlar la fiebre aftosa:
1. Principalmente el control de la fiebre aftosa se debe realizar sobre la base de la separación entre especies endémicas, como los búfalos, y especies susceptibles, como los bovinos.
2. Hay que realizar unas estrictas campañas de vacunación bianual contra fiebre aftosa.
3. Se deben utilizar animales centinelas para monitorear niveles de anticuerpos.
4. Se recomienda realizar inspección, vigilancia y control permanente a los animales susceptibles, lo cual debe estar a cargo de los médicos veterinarios.
5. Es imprescindible controlar la movilización de animales, especialmente los infectados, puesto que son el factor de riesgo más importante para la propagación de la fiebre aftosa. También es necesario tener en cuenta los productos derivados de las especies susceptibles.
6. Para la definición de los patrones epidemiológicos, se debe contar con el enfoque basado en los ecosistemas de áreas endémicas primarias (áreas de mantenimiento de virus), las zonas endémicas secundarias (áreas de la propagación de virus) y las zonas epidémicas (áreas de brotes explosivos) (Rweyemamu et al., 2008).
7. Vergne y colaboradores (2012) concluyeron que la situación de la fiebre aftosa en Camboya es altamente enzoótica, y los aldeanos no notifican los animales clínicamente afectados; por lo tanto, se debe llevar un subregistro de la enfermedad. Como punto clave para el control de la fiebre aftosa, es necesaria una notificación oportuna de esta por parte de las aldeas, las autoridades veterinarias y el sistema de vigilancia (Probert et al., 2016).
Referencias
Berrian, A. M., van Rooyen, J., Martínez-López, B., Knobel, D., Simpson, G. J., Wilkes, M. S. y Conrad, P. A. (2016). One Health profile of a community at the wildlife-domestic animal interface, Mpumalanga, South Africa. Preventive Veterinary Medicine, 130, 119-128.
Brahmbhatt D., Fosgate G., Dyason E., Budke C. y Gummow B. (2012). Contacts between domestic livestock and wildlife at the Kruger National Park Interface of the Republic of South Africa. Preventive Veterinary Medicine, 103, 16-21.
Colenutt, C., Gonzales, J. L., Paton, D. J., Gloster, J., Nelson, N. y Sanders, C. (2016). Aerosol transmission of foot-and-mouth disease virus Asia-1 under experimental conditions. Veterinary Microbiology, 189, 39-45.
Dion, E., VanSchalkwyk, L. y Lambin E. (2011). The landscape epidemiology of foot-and-mouth disease in South Africa: A spatially explicit multi-agent simulation. Ecological Modelling, 222(13), 2059-2072.
Dion, E. y Lambin, E. (2012). Scenarios of transmission risk of foot-and-mouth with climatic, social and landscape changes in southern Africa. Applied Geography, 35(1-2), 32-42.
Elnekave, E., van Maanen, K., Shilo, H., Gelman, B., Storm, N., Alhalq, M. A. y Klement, E. (2016). Prevalence and risk factors for foot and mouth disease infection in cattle in Israel. Preventive Veterinary Medicine, 130, 51-59.
Emami, J., Rasouli, N., McLaws, M. y Bartels, C. J. M. (2015). Risk factors for infection with foot-and-mouth disease virus in a cattle population vaccinated with a non-purified vaccine in Iran. Preventive Veterinary Medicine, 119(3), 114-122.
Hargreaves, S., Foggin C., Anderson E. A., Bastos D. y Thomson, G. (2004). An investigation into the source and spread of foot and mouth disease virus from a wildlife conservancy in Zimbabwe. Scientific and Technical Review of the Office International des Epizooties, 23(3), 783-790.
Jori, F., Brahmbhatt, D., Fosgateb, G., Thompson, P., Budke, C., Ward, M., et al. (2011). A questionnaire-based evaluation of the veterinary cordon fence separating wild life and livestock along the boundary of the Kruger National Park, South Africa. Preventive Veterinary Medicine, 100(3-4), 210-220.
Jori, F. y Etter, E. (2016). Transmission of foot and mouth disease at the wildlife/livestock interface of the Kruger National Park, South Africa: Can the risk be mitigated? Preventive Veterinary Medicine, 126, 19-29.
Probert, W. J., Shea, K., Fonnesbeck, C. J., Runge, M. C., Carpenter, T. E., Dürr, S. et al. (2016). Decision-making for foot-and-mouth disease control: Objectives matter. Epidemics, 15, 10-19.
Читать дальше













