Lösliche Hartsubstanzproteine
Die löslichen Knochenproteine können aus der entkalkten Knochenmatrix durch das Lösungsmittel Guanidinhydrochlorid in Lösung gebracht werden. Es bleibt dann die kollagene Knochenmatrix zurück (Abb. 2-3). Die lösliche Proteinfraktion enthält unter anderem Signalmoleküle (Wachstumsfaktoren und Differenzierungsfaktoren) und etwa 40 bekannte knochenspezifische Proteine, wie Osteopontin, Bone Sialoprotein und Osteocalcin. In der löslichen Fraktion befinden sich auch die BMP = Bone Morpogenetic Proteins (etwa 1 mg pro kg Knochen). Allogene Knochentransplantate werden bei der Herstellung manchmal teilweise entkalkt, sodass die natürlichen BMPs besser in der Wunde verfügbar sind. Das Material wird als DFDBA (Demineralized freeze dried bone allograft) bezeichnet.
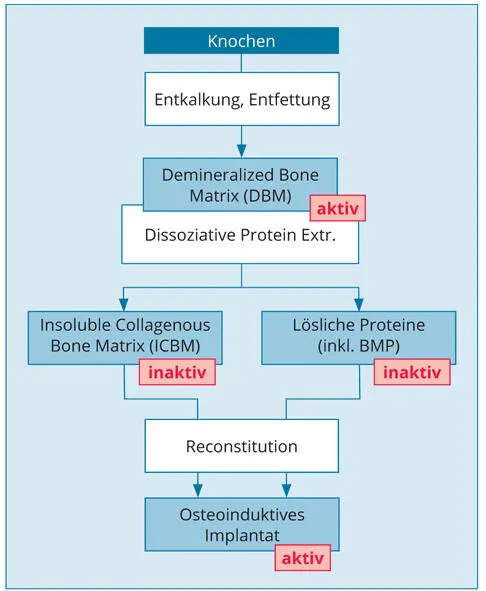
Abb. 2-3Knochenbestandteile wie sie durch schrittweise Behandlung mit Säuren und Lösungsmitteln extrahiert werden können. Für sich alleingenommen sind BMP oder Knochengrundsubstanz allein inaktiv. Nur, wenn man die einzelnen Bestandteile wieder zusammenführt, entsteht ein osteoinduktives Knochenersatzmaterial. Beispielsweise kann man rekombinantes BMP mit Knochenersatzmaterial kombinieren, um ein aktives Transplantat zu erhalten.
2.2Wundheilung
Die Wundheilung kann gedanklich in vier Phasen eingeteilt werden (Abb. 2-4). Jede Wunde, ob in Knochen oder Weichgewebe, durchläuft diese vier Phasen, die sich zeitlich überlappen.
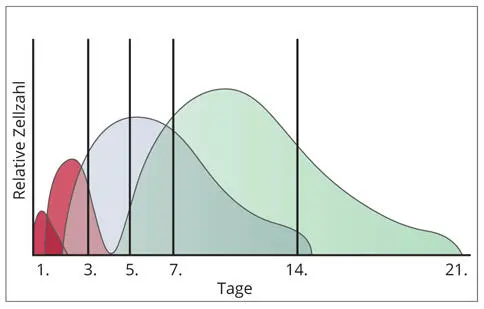
Abb. 2-4Die vier zeitlich überlappenden Phasen der Wundheilung im Weichgewebe. Die y-Achse bezeichnet die relative Zellmenge.
Exsudative Phase (Koagulum)
Die erste Phase der Wundheilung ist die exsudative Phase, die einige Minuten bis Stunden dauert. Kennzeichen ist die Blutstillung durch Plättchen und die Polymerisation des Fibrins, das eine provisorische Extrazellulärmatrix bildet. Diese ist notwendig zur Speicherung von Wachstumsfaktoren und als Gerüststruktur für das Einwandern der Zellen der Wundheilung. Wenn der Knochen mechanisch durch eine Implantatbohrung verletzt wird, entsteht ein Defekt. In diesen Defekt blutet es aus dem Knochenmark ein. Das Koagulum verklebt mit den Wundrändern und stabilisiert durch Gerinnungs- und andere Proteine, z. B. Fibronektin, bereits in den ersten Stunden die Wunde mechanisch. Zahnärzte sind mit der Wichtigkeit des Blutkoagulums durch das Krankheitsbild der schmerzhaften fibrinolytischen Alveolitis (trockene Alveole, Dolor post extractionem) vertraut.
Entzündliche Phase (Reinigung)
Diese Phase wird durch die Degranulation der Thrombozyten eingeleitet und dauert Stunden bis Tage. Die freigesetzten Signalstoffe, vasoaktive Substanzen wie Bradykinin wirken auf die Blutgefäße im Wundrand. Die Blutgefäße werden durchlässig und ein Ödem entsteht. Die Blutstromgeschwindigkeit verlangsamt sich, sodass Granulozyten leichter an der Gefäßwand adhärent werden können, um letztlich durch feine Lücken zwischen den Endothelzellen in den perivaskulären Raum auszutreten (Diapedese). Hier beginnen sie mit der Zerstörung und Phagozytose von Bakterien, chemotaktisch angelockt von Bakterienprodukten wie Lipopolysacchariden und von Komplementsignalen (Opsonierung = Markierung von Bakterien durch Komplementproteine). Chemotaxis bedeutet das Anlocken mit gezielter Richtungsangabe für einwandernde Zellen durch ein Konzentrationsgefälle. Das zusätzliche Zellvolumen der Entzündungszellen ist klinisch als Schwellung erkennbar. Granulozyten erzeugen durch freie Sauerstoffradikale ein toxisches Wundmilieu, wenn sie in großer Zahl auftreten, weil sie zum Beispiel fortwährend auf neue bakterielle Antigene stoßen. Durch Zerfall setzen Granulozyten gewebeauflösende Enzyme aus ihren Lysosomen frei, bis das Gewebe flüssig ist und sich Eiter bildet. Eiter ist ein physiologischer Reinigungsmechanismus des Körpers in Fortsetzung der Arbeit der Granulozyten.
Den Granulozyten folgen die Makrophagen, die unter den sauerstoffarmen Bedingungen eines Wundrandes trotzdem überleben können, und hier durch Sezernieren von VEGF (Vascular Endothelial Growth Factor) die Gefäßneubildung und damit die nächste Phase initiieren können.
Proliferative Phase (Heilung)
Wenn eine Wunde sauber ist, können Makrophagen Wachstumsfaktoren wie Transforming Growth Factor Beta (TGF-b), Insulin Like Growth Factor (IGF) und Vascular Endothelial Growth Factor (VEGF) sezernieren. Diese Faktoren induzieren die Bildung des Granulationsgewebes, das die provisorische Matrix des Koagulums ersetzt. Die proliferative Phase überlappt mit den angrenzenden Phasen und dauert Tage bis Wochen. Angeregt durch VEGF aus Makrophagen lösen sich perivaskuläre Zellen der angrenzenden Blutgefäße, teilen sich und versammeln sich zu Infiltraten. Sie vereinigen sich und bilden Röhren, die sich an die bestehenden Blutgefäße anschließen. Dann können sie durchströmt werden und so die Sauerstoffversorgung im Defektgebiet verbessern. Den Gefäßen nachfolgend wandern chemotaktisch Fibroblasten ein. Diese stoßen in der Extrazellulärmatrix des Blutkoagulums auf die gespeicherten Wachstumsfaktoren und beginnen mit der Kollagenbildung. Bis hierher ist die Wundheilung weitgehend unspezifisch und gleicht sich in Weichgewebewunden und Kieferknochenwunden. Allerdings laufen die nun folgenden Phasen im Weichgewebe viel schneller als im Knochen ab.
Für den Unterschied der Knochenwunden zu Weichgewebewunden sind die Bone Morphogenetic Proteins (BMP) verantwortlich. Sie sind im Knochen gespeichert und werden bei Verletzungen des Knochens durch Fraktur oder Osteotomie freigesetzt. Eine wichtige Quelle sind auch Knochenchips (z. B. Scraper) oder der Bohrstaub in einer Implantatalveole, die daher tunlichst nicht vor der Implantatinsertion ausgespült werden sollte. Das BMP führt zur Differenzierung von mesenchymalen Stammzellen zu Knochenvorläuferzellen. Die entstehenden Osteoblasten können nur auf einer festen Grundlage existieren und verankern sich, vermittelt durch Integrine und Osteopontin, an Knochenbälkchen in ihrer Umgebung. Wenn diese Verankerungen den Zellen (Mechanorezeptoren) mechanische Ruhe signalisieren, beginnen sie mit der Expression knochenspezifischer Matrixproteine (Osteoid), ausgehend von der verletzten Knochenoberfläche.
Wenn die proliferative Phase ungestört abläuft, mineralisiert die Matrix und es bildet sich jetzt ein Geflechtknochen innerhalb einiger Wochen (Abb. 2-5). Die Knochenbildung kann auch auf osteokonduktiven Oberflächen in Reichweite der Osteoblasten verlaufen. Osteokonduktive Oberflächen sind Zahnimplantate oder Knochenersatzmaterialien (Abb. 2-6), wobei diese erst mit einem Proteinfilz überdeckt sein müssen. Das in dieser Schicht enthaltene Fibronektin nutzen die Osteoblasten zur mechanischen Verankerung. Am Kieferknochen herrscht eine desmale Ossifikation vor. Ein Zwischenstadium von Knorpel (enchondrale Ossifikation) wie an den Extremitäten tritt am Kieferknochen, an dem eine desmale Ossifikation vorherrscht, nicht auf.
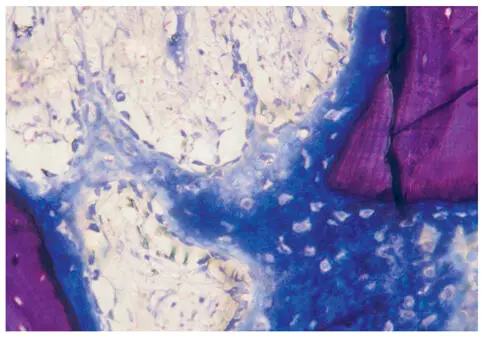
Abb. 2-5Initiale Geflechtknochenbildung im Rahmen eines Sinuslifts mit Knochenersatzmaterialgemisch nach 6 Wochen. Präosteoblasten verdichten sich, lagern sich um eine Osteoidmatrix, welche in Richtung des rechten Bildrandes bereits zunehmend mineralisiert (Labor MKG Kiel, unentkalkter Hartschliff, Toluidinblau, Schwein, 200fach).
Читать дальше















