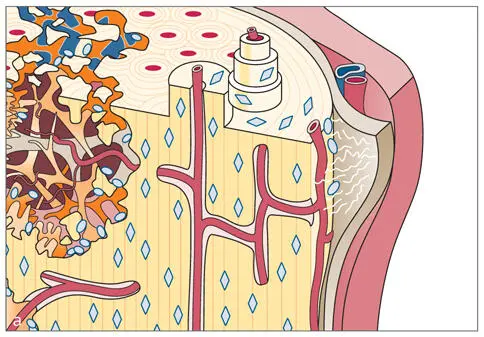
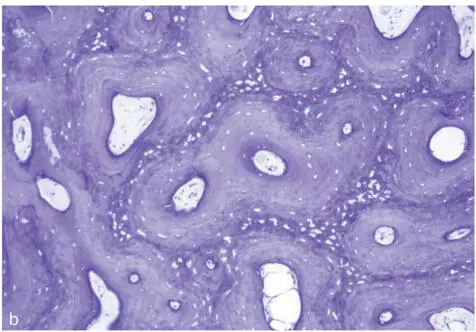
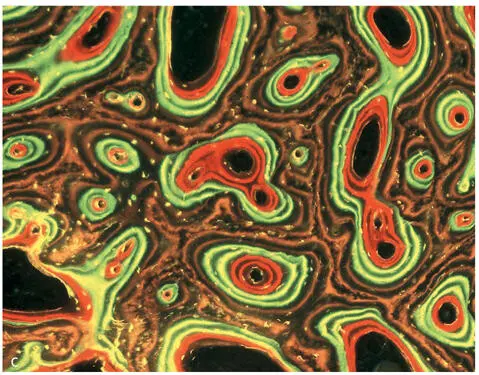
Abb. 2-1a. Knochen gehört zu den stark durchbluteten Gewebearten. Zwischen den Zentralgefäßen der Osteone, zum Periost und ins Knochenmark bestehen Querverbindungen. b. In der Toluidinblaufärbung sieht ein Querschnitt durch den kortikalen Knochen recht homogen aus (Labor MKG Kiel, unentkalkter Hartschliff, Schwein, 20fach). c. Ein ähnliches Präparat wie 2-1b nach intravitaler Markierung durch Fluoreszenzfarbstoffe wirkt deutlich lebhafter. Es zeigt die Bildung von Osteonen in kompaktem Knochen. Nach Beleuchtung mit UV-Licht erstrahlen die Wachstumsbanden Xylenolorange 2 und 3 Wochen, Calceingrün 4 und 5 Wochen, Alizarinkomplexonrot 6 und 7 Wochen (Labor MKG Kiel, unentkalkter Hartschliff, Schwein, 20fach).
Der Oberkiefer weist eine eher spongiöse Struktur und einen peripheren Blutversorgungstyp auf. Der Oberkiefer wird über verschiedene Arterienstromgebiete (A. palatina m., A. alveolaris sup. ant./post., A. nasopalatina) über einen Plexus großenteils von peripher mit periostalen Gefäßen ernährt (Abb. 2-2). Dadurch ist der Oberkieferknochen auch dann noch über das Periost ernährt, wenn Teile der inneren Gefäßversorgung beispielsweise durch Osteotomien oder Knochensegmentbildungen unterbrochen sind.
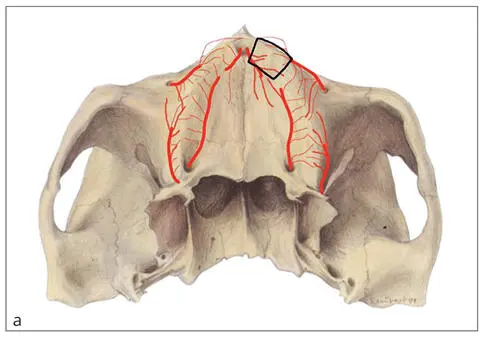
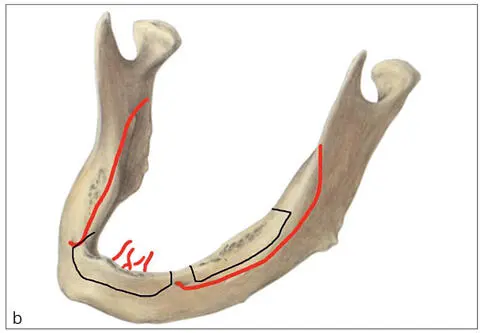
Abb. 2-2a. Peripherer Durchblutungstyp im Oberkiefer über multiple periostale Gefäße. b. Zentraler Durchblutungstyp im Unterkiefer über das Zentralgefäß der Arteria alveolaris inferior.
Der Unterkiefer hingegen weist eine wesentlich empfindlichere Gefäßversorgung vom zentralen Typ auf. Große Teile des horizontalen Astes werden fast ausschließlich vom Zentralgefäß der Arteria alveolaris inferior ernährt. Lediglich der mittlere Anteil des Kinnbogens erhält seine Ernährung durch einige Gefäße aus dem Mundboden. Die Zentralarterie ist insbesondere bei älteren Patienten häufig infolge von Arteriosklerose verschlossen, dann kommt es zur Stromumkehr in der Arteria mentalis 1 . Neben den ernährenden Gefäßen beherbergt der Knochen im Knochenmark das blutbildende Gewebe, das ein zerfließliches Gewebe ohne Eigenstabilität ist. Im Inneren des Knochens liegt das Knochenmark im Gegensatz zu anderen Körperorten an einem Ort mechanischer Ruhe und äußerer Stabilität. Hier liegen auch mesenchymale Stammzellen, die der Ursprung der Knochenheilung sind.
Knochenzellen
Die eigentlichen Knochenzellen besitzen Vorläuferzellen (pluripotente mesenchymale Stammzellen, Osteoprogenitorzellen), die eine Regenerationsreserve darstellen. Neben dem Knochenmark weiß man heute, dass die Perizyten oder perivaskulären Zellen der Blutgefäße die pluripotenten mesenchymalen Stammzellen sind 2 . Das ist praktisch, denn es kann keine größere Knochenregenration ohne Blutversorgung geben. Bei Bedarf differenzieren sich diese Zellen in Osteoprogenitorzellen und schließlich nach Adhärenz an eine Matrix in Osteoblasten, die Osteoid aufbauen und sich danach als Osteozyten in die Matrix einmauern. Einige bedecken als Deckzellen (lining cells) die gesamte Knochenoberfläche zur Markhöhle hin lückenlos. Wenn die Deckzellenschicht Lücken bekommt, z. B. durch chirurgisches Trauma, ist das ein Signal zur Osteoklastenentwicklung. Das erklärt ebenfalls die Oberflächenresorption nach Deperiostierung.
Osteoklastenfunktion
Die Osteoklastenfunktion steht unter dem Einfluss von Osteoblasten. Osteoblasten besitzen Rezeptoren für die verschiedensten Hormone und Botenstoffe und können unter Einfluss von Parathormon RANKL (Receptor activator of nuclear factor kappa beta ligand) produzieren. Zusammen mit M-CSF (Macrophage colony stimulating factor) steuern sie so das Konfluieren von monozytischen Vorläuferzellen zu mehrkernigen Osteoklasten. Osteoklasten sind Immunzellen und stammen wie die Makrophagen von Monozyten des Blutstroms ab, die ihrerseits von hämatopoetischen Stammzellen des Knochenmarks abstammen. An Stellen, wo die Lining cells sich abheben, heften sich Osteoklasten an die freien Knochenstellen an. Die Anheftung erfordert das Protein Osteopontin aus der Knochenmatrix, das sich ringförmig mit Integrinen der Osteoklasten verbindet. So entsteht eine Art Saugnapf der Osteoklasten, innerhalb dessen ein sehr stark saures Milieu durch Protonenpumpen erzeugt werden kann, ohne dass die Säure ins übrige Gewebe austritt. Die Säure entkalkt den Knochen, sodass dessen Proteine nun für den Angriff durch saure Enzyme wie Cathepsin freigelegt werden. Die Howship-Lakune entsteht (John Howship 1781–1841, Chirurg und pathologischer Anatom, London). Durch Endozytose wird alles, was im Spalt in Lösung geht, in das Zellinnere transportiert und hier weiter verdaut. Wenn sich unter diesen Molekülen bakterielles Lipopolysaccharid befindet, kann durch Toll-like-Rezeptoren eine schnelle entzündliche Resorption initiiert werden 3 , die meistens sehr schnell zur Zahn- oder Knochenauflösung führt. Die entzündliche Resorption füllt sich im Gegensatz zur Ersatzresorption beim Knochenumbau nicht knöchern auf; sie ist aufgrund des proinflammatorischen Wundmilieus inkompatibel mit einer Knochenbildung. Sie hinterlässt Defekte und Sequester, sodass der Knochenchirurg vorbeugend um eine bakterienarme Wunde bemüht ist.
Knochengrundsubstanz
Das Hartgewebe des Knochens ist ein Verbundwerkstoff aus Fasern und Füllmasse, wobei die Fasern Zugbelastungen und die Füllmasse die Druckbelastungen aufnimmt. Für solche Verbundwerkstoffe gibt es in der Technik viele Beispiele (z. B. Stahlbeton oder glasfaserverstärkter Kunststoff im Bootsbau). Die Knochenmatrix besteht überwiegend aus Kollagen (Fasern) und Mineral in Form von Hydroxylapatitkristallen (Füllstoff). Dieses Mineral ist bei pH 7,4 in Wasser praktisch unlöslich, was sich bei saurem pH schnell ändert (siehe Kariesentstehung). Das Mineral kann technisch durch Säurebehandlung aus dem Knochenverbund ausgelöst werden, um an die Proteine des Knochens zu gelangen. Das Knochenmineral Hydroxylapatit ist Vorbild für die vielen mineralischen Knochenersatzmaterialien, denn der Körper akzeptiert bestimmte technisch hergestellte Materialien als künstliche Knochenmatrix, bzw. können die Knochenvorläuferzellen diese mangels Proteinstrukturen nicht als fremd erkennen.
Nichtlösliche Hartsubstanzproteine
Die nach Auflösen des Minerals zurückbleibenden Proteine werden in lösliche und unlösliche Knochenproteine eingeteilt. Kollagen Typ I ist mengenmäßig der wichtigste Vertreter der unlöslichen Proteine. Die Stabilität von Knochen wird durch seine innere Struktur bestimmt. Diese innere Struktur ergibt sich aus der Verlaufsrichtung der Kollagenfasern, die wie Drähte den Knochen innerlich zugfest machen. Die innere Verlaufsrichtung der Kollagenfasern kann in polarisiertem Licht dargestellt werden. Der Grundbaustein des ausgereiften kortikalen Knochens ist das Osteon mit dem zentralen Havers-Kanal. Die Kollagenfasern sind im lamellären Knochen parallel schraubenartig in Längsrichtung in gegenläufigen Touren wie kreisrundes Sperrholz um das Osteon gewickelt und erklären so die hohe mechanische Stabilität dieses Knochentyps. Der im Gegensatz dazu unreife Geflechtknochen bildet sich bei der Wundheilung zunächst. Im Geflechtknochen sind die Kollagenfasern nicht parallel, sondern geflechtartig angeordnet und können damit Kräfte gleichmäßig aus allen Richtungen aufnehmen.
Читать дальше

















