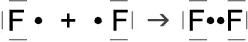Begründung:
Der Metallcharakter eines Elementes ist
davon abhängig, wie bereitwillig ein Atom seine Außenelektronen abgeben möchte. Ein Atom tendiert umso stärker dazu, Au-ßenelektronen abzugeben
- je weniger Außenelektronen vorhanden sind,
- je größer der Atomradius und damit der Abstand vom Atomkern ist,
- je kleiner die Protonenzahl ist.
In den Perioden nimmt die Anzahl der Au-ßenelektronen von rechts nach links ab, die Protonenzahl nimmt ab und die Atomradi-en werden in dieser Richtung größer. In den Hauptgruppen werden die Atomradien von oben nach unten größer (Die gleichzeitige Zunahme der Protonenzahl ist demgegen-über von untergeordneter Bedeutung).
Der Nichtmetallcharakter eines Elements ist davon abhängig, wie stark ein Atom seine Außenschale durch Aufnahme von Frem-delektronen auffüllen möchte. Ein Atom tendiert umso eher dazu
- je mehr Außenelektronen vorhanden sind,
- je kleiner der Atomradius ist,
- je größer die Protonenzahl ist.
In den Perioden wird die Anzahl der Au-ßenelektronen und die Protonenzahl von links nach rechts größer und die Atomra-dien kleiner. In den Hauptgruppen werden die Atomradien von unten nach oben klei-ner; die gleichzeitige Abnahme der Proto-nenzahl ist demgegenüber von untergeord-neter Bedeutung.

Periodensystem


18

Elektronegativität (EN)
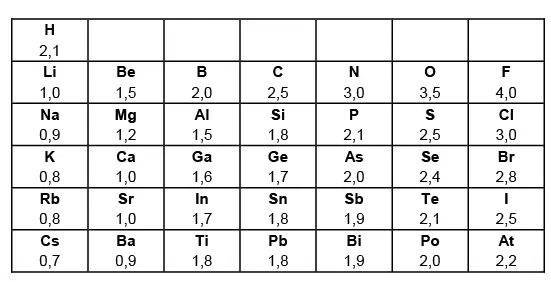
Elektronegativitäten von Hauptgruppenelementen
Die Größe der EN eines Atoms hängt da-von ab, wie stark die Außenelektronen vom positiven Kern angezogen werden. Inner-halb einer Periode nimmt die EN von links nach rechts zu (Begründung: Die Kernla-dungszahl steigt); innerhalb einer Haupt-gruppe nimmt die EN von oben nach unten ab (Begründung: Atomradius steigt) Die Größe der Elektronegativität (abgekürzt EN) bzw. Elektronegativitätsdifferenz (ab-gekürzt ∆ EN) zwischen 2 Atomen spielt eine große Rolle:
a) bei chemischen Bindungen (Hier gibt ∆ EN die Bindungsart an, siehe Kapitel 3),
b) beim Aufstellen chemischer Reaktions-gleichungen.
Wiederholungsfragen
1. Welche Gemeinsamkeit haben die Ato-me der Elemente der gleichen Haupt-gruppe?
2. Welche Gemeinsamkeit haben die Ato-me der Elemente der gleichen Periode?
3. Wie viele Protonen haben die Atome des Elements mit der Ordnungszahl 48?
4. Warum wird das Helium zur 8. Haupt-gruppe gezählt, obwohl es nur 2 Elekt-ronen hat?
5. Wie verändern sich Atomradien
a) innerhalb einer Hauptgruppe
b) innerhalb einer Periode?
6. Warum ist die Reaktionsfreudigkeit des Elements Lithium kleiner als die des Elements Kalium?
7. Wie nennt man die Elemente der
a) 1. Hauptgruppe
b) 7. Hauptgruppe
c) 8. Hauptgruppe?
8. Welche grundsätzlichen Eigenschaften haben die Elemente der 1. Hauptgrup-pe im Vergleich zu den Elementen der 8. Hauptgruppe (Begründung)?
9. Wo befinden sich im PSE vorwiegend
a) Metalle
b) Nichtmetalle?
10. Wie verändert sich die Elektronegativi-tät innerhalb des Periodensystems der Elemente (Begründung)?
Periodensystem
Darunter versteht man das Bestreben eines Atoms, Elektronen anzuziehen.
Linus Pauling, ein ame-rikanischer Chemiker (1954 Nobelpreis für Chemie, 1962 Träger des Friedensnobelprei-ses) gab dem Element mit der höchsten Elekt-ronegativität, dem Fluor willkürlich den Wert 4.
Die folgende Tabel-
le zeigt die Elektronegativitäten einiger Hauptgruppenelemente:


19
Chemische Bindungen
Alle Atome haben das Bestreben, eine voll besetzte, abgesättigte Außenschale (Edel-
gaszustand) zu erreichen. Dazu gehen sie chemische Bindungen mit gleichen oder verschiedenen Atomen ein. Je nachdem, welche Atome vorliegen, sind die Bindungs-arten unterschiedlich. Wir unterscheiden die Bindungsarten:
Atombindung (Elektronenpaarbin-dung, kovalente Bindung)
Ionenbindung
Metallbindung
Die Atombindung (Elektronenpaarbindung, kovalente Bindung)
Sie tritt zwischen Nichtmetallatomen auf. Wenn 2 gleiche Nichtmetall-Atome eine Verbindung eingehen, spricht man von einer kovalenten oder unpolaren Atom-
bindung. Wenn sich 2 verschiedene Nicht-metallatome miteinander verbinden, nennt man die Bindungsart polare (polarisierte) Atombindung
Atombindung zwischen gleichen Atomen
Einfachstes Beispiel dieser Atombindung ist die Bindung zwischen Wasserstoffatomen. Jedes H-Atom hat ein Elektron auf seiner äußersten Schale (K-Schale). Die K-Schale benötigt für die Edelgaskonfiguration jedoch zwei Elektronen. Bei der Atombin-dung lagern sich zwei Wasserstoff-Atome zusammen und bilden ein gemeinsames Elektronenpaar. Dieses gehört der K-Schale beider Atome an. Dadurch haben beide Atome eine voll besetzte Außenschale (Edelgasschale des Heliums) und bilden so ein H2-Molekül.
Ähnlich ist es bei der Bindung zwischen zwei Atomen der 7. Hauptgruppe z. B. zwei Fluor-Atomen. Diese haben je sieben Elektronen auf ihrer äußersten Schale, der L-Schale.

Von den beiden Fluor-Atomen behält jedes sechs Außenelektronen für sich alleine; mit dem 7. bilden sie ein gemeinsames Elekt-ronenpaar, so dass beide auf diese Weise eine voll besetzte, abgesättigte Außenschale erreichen.
Wegen der Bildung von gemeinsamen Elek-tronenpaaren nennt man diese Bindung auch Elektronenpaarbindung.
Durch die Elektronenpaarbindung entstehen Moleküle. Unedle Gase wie Wasserstoff, Stickstoff, Sauerstoff, Fluor und Chlor kommen immer molekular vor als H2, N2, O2, F2, Cl2. Der Index „2“ besagt hier, dass jeweils zwei Atome durch Atombindung verbunden sind.
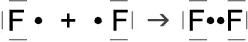
Chemische Bindungen

20

Schreibweisen für die Atombindung
Für Atombindungen gibt es die folgenden Schreibweisen:
a) Elektronenformel (Punktformel)
Dabei wird jedes Außenschalen-Elektron als ein Punkt dargestellt, die gemeinsamen Elektronenpaare werden zwischen die Buchstabensymbole geschrieben.
b) Elektronenpaarformel (Strichformel)
Читать дальше